沼气是一种能源,它的主要成分是CH4。0.5 mol CH4燃烧完全后生成CO2和液态H2O时,放出445 kJ的热量。则下列热化学方程式中正确的是 ( )
| A.CH4(g)+2O2(g) = CO2(g)+ H2O(g); ΔH =" —890" kJ·mol-1 |
| B.CH4(g)+2O2(g)=CO2(g)+2H2O(l); ΔH =+890 kJ·mol-1 |
| C.CH4(g)+2O2(g)=CO2(g)+2H2O(l); ΔH =-890 kJ·mol-1 |
| D.1/2CH4(g)+O2(g)=1/2CO2(g)+2H2O(g); ΔH =-445kJ·mol-1 |
已知298 K时,合成氨反应N2(g)+3H2(g)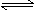 2NH3(g)ΔH=-92.0 kJ·mol-1,将此
2NH3(g)ΔH=-92.0 kJ·mol-1,将此
温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反
应放出的热量为(假定测量过程中没有能量损失) ( )
| A.一定小于92.0 kJ | B.一定大于92.0 kJ |
| C.一定等于92.0 kJ | D.无法确定 |
某温度下,反应2N2O5 4NO2+O2开始进行时,c(N2O5)=0.040 8 mol/L。经1 min后,c(N2O5)=0.030 mol/L。则该反应的反应速率为( )
4NO2+O2开始进行时,c(N2O5)=0.040 8 mol/L。经1 min后,c(N2O5)=0.030 mol/L。则该反应的反应速率为( )
| A.v(N2O5)=1.8×10-4 mol/(L·s) | B.v(N2O5)=1.08×10-2 mol/(L·s) |
| C.v(NO2)=1.8×10-4 mol/(L·s) | D.v(O2)=1.8×10-4 mol/(L·s) |
下列各说法中,正确的是 ( )
| A.ΔH>0表示放热反应,ΔH<0表示吸热反应 |
| B.热化学方程式中的化学计量数只表示物质的量,可以是分数 |
| C.1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热 |
| D.1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热 |
改变反应条件使化学平衡向正反应方向移动时,下列变化中正确的是
| A.生成物浓度一定增大 | B.生成物的物质的量分数一定增大 |
| C.反应物的转化率一定增大 | D.某生成物的产率可能提高 |
能源可划分为一次能源和二次能源,直接来自自然界的能源称为一次能源;需依靠其他能源的能量间接制取的能源称为二次能源。下列叙述正确的是
| A.水煤气是二次能源 | B.水力是二次能源 |
| C.天然气是二次能源 | D.电能是一次能源 |