(12分)①制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2。
②用NaOH测定滤液的浓度:准确称量1.000gNaOH固体质量,配制成250mL溶液,准确量取25.00mL溶液装在碱式滴定管,滴加2滴酚酞作指示剂。把滤液装在酸式滴定管中,调节液面排除气泡后,滤液的凹液面刚好在“0”刻度,滴定NaOH溶液,达到终点记录读数。实验重复3次。记录见下表。
| 滴定次数 |
NaOH溶液体积/mL |
滴定消耗滤液体积/mL |
| 1 |
25.00 |
20.02 |
| 2 |
25.00 |
17.10 |
| 3 |
25.00 |
19.98 |
请回答下列问题:
(1)TiCl4水解生成TiO2·xH2O的化学方程式为_______________________________。
(2) 配制成250mL溶液使用的量具是 ,指示剂还可用____________;
(3) 滴定终点的现象是_______________________。
(4) 滤液中溶质的物质的量浓度为_____________。
(5) 若在滴定终点读取滴定管刻度时,俯视标准液液面,使对测定结果________。 (填“偏高”、“偏低”或“无影响”)
现有X、Y、Z、W四种常见元素,其中X、Y、Z为短周期元素。有关信息如下表:
| 原子或分子相关信息 |
单质及其化合物相关信息 |
|
| X |
ZX4分子空间结构为正四面体 |
X的最高价氧化物对应的水化物为无机酸中最强酸 |
| Y |
Y原子的最外层电子数等于电 |
Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料(人造刚玉) |
| Z |
Z原子的最外层电子数是次外层电子数的 |
Z是无机非金属材料的主角,其单质为原子晶体,是一种优良的半导体材料 |
| W |
W原子的最外层电予数小于4 |
W的常见化合价有+3、+2,WX3稀溶液呈黄色 |
(1)W位于周期表第四周期第族,W(OH)2在空气中不稳定,极易被氧化,由白色迅速变成灰绿色,最后变成红褐色,反应的化学方程式为。
(2)Z最简单的氧化物分子是分了(填“极性”或“非极性”):工业上用Z的氧化物制备其单质的化学反应方程式为。
锗与Z是同一主族元素,门捷列夫曾预言了这一元素的存在,它最常用来制造晶体篱,最新研究表明:有机锗具有明显的抗肿瘤活性,锗元素的最高价氧化物的化学式为。
(3)实验室制取X单质的离子方程式为;X的气态氧化物的水溶液与Y的氧化物反应的离子方程式为。
(4)在50mL lmol·L-1的YX3溶液中逐滴加入0.5mol·L-1的NaOH溶液,得到1.56g沉淀,则加入NaOH溶液的体积可能为mL或mL。
已知有下图所示物质相互转换关系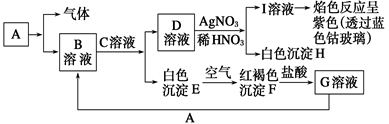
试回答:
(1)写出B的化学式,D的化学式。
(2) 写出由E转变成F的现象;其发生反应的化学方程式________。
写出由E转变成F的现象;其发生反应的化学方程式________。
(3)鉴别B溶液中阳离子的操作方法及实验现象__________________;
(4)向G溶液中加入A的离子方程式________
有一透明溶液,可能含有较大量的Mg2+、Fe3+、Al3+、Cu2+、Na+、H+、SO、CO中的一种或几种,取此溶液做下列实验:①取少量溶液加入用盐酸酸化的BaCl2溶液,有白色沉淀生成;
②取少量溶液加入过氧化钠粉末,溶液中有白色沉淀产生并逸出无色无味的气 体,加入Na2O2的物质的量与析出沉淀的物质的量如图所示。试推断:
体,加入Na2O2的物质的量与析出沉淀的物质的量如图所示。试推断: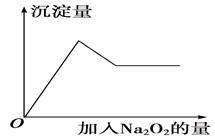
(1)溶液中一定含有的离子是______________ 。
。
(2)溶液中肯定不含有的离子是_______________ _。
_。
(3)可能含有的离子是____________。
A 、B、C、D是四种可溶性化合物,分别由阳离子K+、Ba2+.、Al3+、 Fe3+和阴离子OH—、CO
、B、C、D是四种可溶性化合物,分别由阳离子K+、Ba2+.、Al3+、 Fe3+和阴离子OH—、CO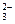 、NO
、NO 、SO
、SO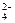 两两组合而成,它们的溶液能发生如下反应:
两两组合而成,它们的溶液能发生如下反应:
(1)A与B反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失。
(2)C与D反应生成有色沉淀。
(3)B与C反应生成白色沉淀。
写出它们的化学式:
A._________;B._________;C._________;D._________;
下图为中学化学中常见物质的转化关系,反应条件及部分反应物和产物未全部注明,已知A、D为金属单质,其他为化合物,试推断:
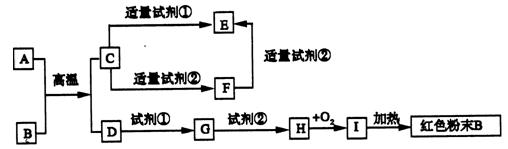
(1)写 出物质的化学式:
出物质的化学式:
(2)写出下列反应的方程式:
C →F的离子方程式:_____________________________________________
→F的离子方程式:_____________________________________________
H→I的化学方程式:______________________________________________