X、Y、Z、W、L、M六种短周期主族元素的原子序数依次增大,其中X、M的单质在常温下呈气态,Y的原子最外层电子数是其电子层数的2倍,Z在同周期的主族元素中原子半径最大,W是地壳中含量最多的金属元素,L的单质晶体熔点高、硬度大,是一种重要的半导体材料。 用化学用语回答下列问题:
(1)L的元素符号为___________;M在元素周期表中的位置为____________________。
(2)Y、L、M的最高价含氧酸的酸性由弱到强的顺序是_________________(写化学式)。
(3)原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是__________________ __。
(4)Z、W各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为________________________________________________________________。
(5)R与Y同周期,R的单质分子R2中有3个共价键,R与L能形成一种新型无机非金属材料,其化学式是___________________。
(10分)最近雾霾天气肆虐我国大部分地区,其中SO2是造成空气污染的主要原因,利用钠碱循环法可除去SO2。
(1)钠碱循环法中,吸收液为Na2SO3溶液,该反应的离子方程式是。
(2)已知H2SO3的电离常数为K1=1.54×10-2,K2=1.024×10-7,H2CO3的电离常数为K1=4.30×10-7,K2=15.60×10-11,则下列微粒可以大量共存的是(填序号)
A.CO32- 、HSO3-B.HSO3-、HCO3-C.SO32- 、HCO3-D.HCO3-、H2SO3
(3)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) |
91:9 |
1:1 |
9:91 |
| pH |
8.2 |
7.2 |
6.2 |
①根据上表判断NaHSO3溶液显 性,试解释原因
②在NaHSO3溶液中离子浓度关系不正确的是
A.c(Na+)=2c(SO32-)+c(HSO3-)
B.c(H2SO3)+c(H+)= c(SO32-)+c(OH-)
C.c(Na+)> c(HSO3-)> c(H+)> c(SO32-)> c(OH-)
D.c(H+)+ c(Na+)=2c(SO32-)+c(HSO3-)+ c(OH-)
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理,常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为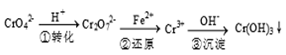
其中第①步存在下列平衡:2CrO42- (黄色) +2H+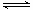 Cr2O72-(橙色) +H2O
Cr2O72-(橙色) +H2O
(1)若平衡体系的pH=2,该溶液显色。
(2)能说明第①步反应达平衡状态的是。
A.Cr2O72-和CrO42-的浓度相同
B.2V(Cr2O72-)=V(CrO42-)
C.溶液的颜色不变
(3)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡
Cr(OH)3(s) 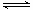 Cr3+(aq)+3OH-(aq)Ksp Cr(OH)3="c" (Cr3+)∙c3(OH-)=10-32
Cr3+(aq)+3OH-(aq)Ksp Cr(OH)3="c" (Cr3+)∙c3(OH-)=10-32
常温下,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至__________。
方法2电解法:
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(4)用Fe做电极的原因为。
(5)在阴极附近溶液pH升高的原因(用电极反应式解释),溶液中同时生成的沉淀还有。
蛇纹石可用于生产氢氧化镁,简要工程如下:
Ⅰ.制取粗硫酸镁:用酸液浸泡蛇纹石矿粉,过滤,并在常温常压下结晶,制得粗硫酸镁(其中常含有少量Fe3+、Al3+、Fe2+等杂质离子)
Ⅱ.提纯粗硫酸镁,将粗硫酸镁在酸性条件下溶解,加入适量的0.1mol/LH2O2溶液,再调节溶液pH至7~8,并分离提纯。
Ⅲ.制取氢氧化镁,向步骤II所得溶液中加入过量氨水。
已知:金属离子氢氧化物沉淀所需pH
| Fe3+ |
Al3+ |
Fe2+ |
Mg2+ |
|
| 开始沉淀时 |
1.5 |
3.3 |
6.5 |
9.4 |
| 沉淀完全时 |
3.7 |
5.2 |
9.7 |
12.4 |
请回答:
(1)步骤II中加入适量的0.1mol/LH2O2溶液的目的是;可用于调节溶液pH至7~8的最佳试剂是(填字母序号)
A.MgO B.Na2CO3 C.蒸馏水 D.NaOH.
(2)工业上常以Mg2+的转化率为考查指标,确定步骤III制备氢氧化镁工艺过程的适宜条件。
其中,反应温度与Mg2+转化率的关系如图所示。
①步骤III中制备氢氧化镁反应的离子方程式为。根据图中所示50℃前温度与Mg2+转化率之间的关系,可判断此反应是(填“吸热”或“放热”反应)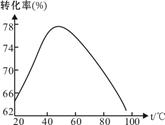
②图中,温度升高至50℃以上Mg2+转化率下降的可能原因是。
常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。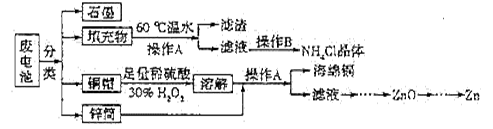
(1)填充物用60℃温水溶解,目的是。
(2)操作A的名称为。
(3)铜帽溶解时加入H2O2的目的是(用化学方程式表示)。铜帽溶解完全后,可采用_____________方法除去溶液中过量的H2O2。
(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为。
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。主要反应为2MnO(OH)+MnO2+2H2C2O4+3H2SO4=2MnSO4+4CO2↑+6H2O。
①当1 mol MnO2参加反应时,共有mol电子发生转移。
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出该反应的化学方程式:。
(6)锌锰干电池所含的汞可用KMnO4溶液吸收。在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如下图所示: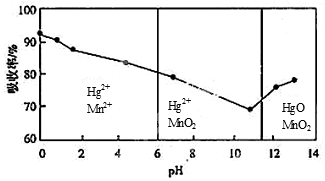
根据上图可知:
①pH对Hg吸收率的影响规律是随pH升高,汞的吸收率___.
②在强酸性环境下Hg的吸收率高的原因可能是KMnO4在酸性条件下强.
某混合物,可能含有以下几种离子:K+、Cl-、NH4+、Mg2+、CO32-、Ba2+、SO42-,若将该混合物溶于水可得澄清溶液,现取3份各100 mL该溶液分别进行如下实验:
| 实验 序号 |
实验内容 |
实验结果 |
| 1 |
加AgNO3溶液 |
有白色沉淀生成 |
| 2 |
加足量NaOH溶液并加热 |
收集到气体1.12 L(已折算成标准状况下的体积) |
| 3 |
加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 |
第一次称量读数为6.63 g,第二次称量读数为4.66 g |
试回答下列问题:
(1)根据实验1对Cl-是否存在的判断是____________(填“一定存在”“一定不存在”或“不能确定”);根据实验1~3判断混合物中一定不存在的离子是____________。
(2)试确定溶液中一定存在的阴离子及其物质的量浓度((可以不填满,也可以增加)):
| 阴离子符号 |
物质的量浓度(mol/L) |
(3)试确定K+是否存在?________,如果存在物质的量浓度为__________,如果不存在理由是___。