某混合物,可能含有以下几种离子:K+、Cl-、NH4+、Mg2+、CO32-、Ba2+、SO42-,若将该混合物溶于水可得澄清溶液,现取3份各100 mL该溶液分别进行如下实验:
| 实验 序号 |
实验内容 |
实验结果 |
| 1 |
加AgNO3溶液 |
有白色沉淀生成 |
| 2 |
加足量NaOH溶液并加热 |
收集到气体1.12 L(已折算成标准状况下的体积) |
| 3 |
加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 |
第一次称量读数为6.63 g,第二次称量读数为4.66 g |
试回答下列问题:
(1)根据实验1对Cl-是否存在的判断是____________(填“一定存在”“一定不存在”或“不能确定”);根据实验1~3判断混合物中一定不存在的离子是____________。
(2)试确定溶液中一定存在的阴离子及其物质的量浓度((可以不填满,也可以增加)):
| 阴离子符号 |
物质的量浓度(mol/L) |
| |
|
| |
|
(3)试确定K+是否存在?________,如果存在物质的量浓度为__________,如果不存在理由是__ _。
(2分)冶炼金属的三种常用方法是:①热分解法②热还原法③电解法。(填序号)
(1)冶炼铝用到的方法是 ;
(2)冶炼铁的常用方法是 。
(13分)烯丙醇(CH2=CH—CH2OH)是一种无色有刺激性气味的液体,是重要的有机合成原料。请回答:
(1)烯丙醇的分子式为 ;烯丙醇中含有的官能团的名称是____。
(2)0.3mol 烯丙醇与足量金属钠反应,能生成标准状况下的氢气__ L。
(3)写出烯丙醇与溴水反应的化学方程式 ,反应类型为___________。
(4)烯丙醇与CH3CO18OH发生酯化反应的化方程式为 ,酯化反应生成的产物在一定条
件下可以发生加聚反应得到高分子化合物,其结构简式为 。
(4分)现有:①二氧化碳②甲烷③二氧化硫④氢氧化铜。根据所学知识,请你在上述四种物质中选择合适的物质填入下列空格中。(填序号)
(1)天然气的主要成分是 ;
(2)医院检验糖尿病要用到的物质是新制的 ;
(3)造成温室效应和全球气候变暖的主要物质是 ;
(4)泄漏到空气中而产生酸雨的主要物质是 。
在室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适反应条件下,它们可以按下列框图进行反应。又知E溶液是无色溶液。请回答: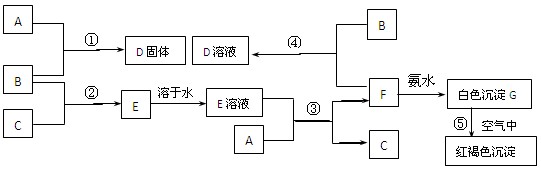
(1)(用化学式填空)
A是______________B是________________
(2)反应①的化学方程式为___________________________________________
反应③的离子方程式为___________________________________________
反应⑤的化学方程式为___________________________________________________
根据要求回答相关问题:
(1)除去下列物质中所混有的少量杂质(括号内为杂质),写出有关的反应方程式。
①铜粉(铝粉) ;
②FeCl3溶液(FeCl2) ;
③N2(O2) 。
(2)下图所示各项变化的未知数中均含有钠元素,E为淡黄色粉末,据此回答下列问题:
①写出A→B的化学方程式,标出电子转移的方向和数目________________________
②在B→C的变化中所得C的溶液往往不纯,其中的杂质(不包括水)可能是 ,主要原因是 ;还可能是 ,主要原因是 。