单斜硫和正交硫转化为二氧化硫的能量变化图如右,下列说法正确的是 
| A.S(s,单斜) = S(s,正交)△H = +0.33kJ·mol -1 |
| B.正交硫比单斜硫稳定 |
| C.相同物质的量的正交硫比单斜硫所含有的能量高 |
| D.①式表示断裂lmol O2中的共价键所吸收的能量比形成1mol SO2中的共价键所放出的能量少297.16kJ |
某温度下,C和水在密闭容器中发生下列反应:C(s)+H2O(g)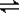 CO(g)+H2(g), CO(g)+H2O(g)
CO(g)+H2(g), CO(g)+H2O(g)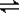 CO2(g)+H2(g)当反应达平衡时,测得c(H2)=1.9 mol/L,c(CO)=0.1 mol/L,则CO2的浓度为( )
CO2(g)+H2(g)当反应达平衡时,测得c(H2)=1.9 mol/L,c(CO)=0.1 mol/L,则CO2的浓度为( )
| A.0.1 mol/L | B.0.9 mol/L |
| C.1.8 mol/L | D.1.9 mol/L |
经一定时间后,可逆反应aA+bB 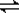 cC中物质的含量A%和C%随温度的变化曲线如图所示。下列说法正确的是( )
cC中物质的含量A%和C%随温度的变化曲线如图所示。下列说法正确的是( )
| A.该反应在T1、T3温度时达到化学平衡 |
| B.该反应在T2温度时达到化学平衡 |
| C.该反应的逆反应是放热反应 |
| D.升高温度,平衡会向正反应方向移动 |
某温度下,反应H2(g)+I2(g)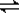 2HI(g)的正反应为放热反应,在带有活塞的密闭容器中达到平衡。下列说法中正确的是( )
2HI(g)的正反应为放热反应,在带有活塞的密闭容器中达到平衡。下列说法中正确的是( )
| A.体积不变,升温,正反应速率减小 |
| B.温度、压强均不变,充入HI气体,开始时正反应速率增大 |
| C.温度不变,压缩气体的体积,平衡不移动,颜色加深 |
| D.体积、温度不变,充入氮气后,正反应速率将增大 |
在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)  xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。下列判断错误的是( )
xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。下列判断错误的是( )
| A.x=1 |
| B.2 min内A的反应速率 为0.3 mol·(L·min)-1 |
| C.B的转化率为40% |
| D.若混合气体的密度不变,则表明该反应已达到平衡状态 |
下列有关反应限度的叙述正确的是( )
| A.使用催化剂,可降低反应的活化能,加快反应速率,改变反应限度 |
| B.依据焓判据:NH4HCO3受热分解可自发进行 |
| C.大多数化学反应在一定条件下都有一定的限度 |
| D.FeCl3与KSCN反应达到平衡时,向其中滴加KCl溶液,则溶液颜色变深 |