A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A与D同主族;C与E同主族;B、C同周期;B原子最外层电子数比其次外层电子数多2;A是周期表中半径最小的元素,C的最外层电子数是内层电子的3倍;F元素是同周期元素中原子半径最小的主族元素。A、B、C、D、E形成的化合物甲、乙、丙、丁的组成如下表所示:
| 化合物 |
甲 |
乙 |
丙 |
丁 |
| 化学式 |
A2C |
A2C2 |
D2C2 |
D2E |
回答下列问题:
(1)写出下列元素名称:A ;指出元素F在周期表中的位置的 。
(2)化合物乙的电子式为 ,用电子式表示形成化合物丁的过程 。
(3)写出丙与甲反应的化学方程式:
(4)固体氧化物燃料电池是以固体氧化锆—氧
化钇为电解质,这种固体电解质在高温下允
许O2-在其间通过,该电池的工作原理如下图所示,其中多孔Pt电极a、b分别是气体C2、A2的载体。①该电池的负极为 (填a或b);O2-流向 极(填“正极”或“负极”)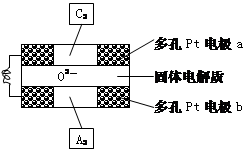
②该电池的正极反应为 ,
负极反应为 。
有H、D、T三种原子它们之间的关系是________。各1mol的H2、D2、T2三种单质中质子数之比是_________;在标准状况下,1L各种单质中它们的电子数之比是________,在标准状况下它们的单质的密度之比是____________。
铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)下图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为________。( 提示:位于晶胞不同位置的离子,可被不同数目的晶胞所共用)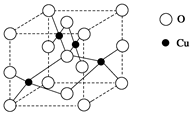
(2)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4 ·H2O,其结构示意图如下: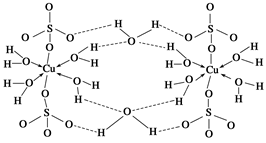
下列说法正确的是 (填字母)。
| A.在上述结构示意图中,所有氧原子都采用sp3杂化 |
| B.在上述结构示意图中,存在配位键、共价键和离子键 |
| C.胆矾是分子晶体,分子间存在氢键 |
| D.胆矾中的水在不同温度下会分步失去 |
( 3)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是___________________。
3)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是___________________。
研究物质的结构是研究物质性质的的基础,分析下列微粒的结构,完成问题:
(1) 根据VSEPR理论,BCl3的立体结构为:_______________,HCN的立体结构为:_________________。(文字表述,不必画图)两分子中中心原子的杂化类型分别为_________ ___________ 。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布式为 ,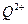 的未成对电子数是。
的未成对电子数是。
(3) 中的
中的 与
与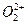 互为等电子体。已知
互为等电子体。已知 、
、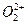 两种粒子中各原子最外层均为8电子稳定结构。
两种粒子中各原子最外层均为8电子稳定结构。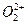 的电子式可表示为 ;
的电子式可表示为 ;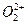 中含有的
中含有的 键数目为。
键数目为。
(1)试写出短周期元素形成的含有14个电子的分子(至少三种)的化学式:,其中和互为等电子体。
(2)CH3CHO分子中,-CH3中的碳原子采用杂化方式,-CHO中的碳原子采取杂化方式。
 Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
Q、R、X、Y、Z五种元素的原子序数依次递增。已知: ①Z的原子序数为29,其余的均为短周期主族元素;
①Z的原子序数为29,其余的均为短周期主族元素; ②Y原子价电子(外围电子)排布msnmpn;
②Y原子价电子(外围电子)排布msnmpn; ③R原子核外L层电子数为奇数;
③R原子核外L层电子数为奇数; ④Q、X原子p轨道的电子总数分别为2和4。
④Q、X原子p轨道的电子总数分别为2和4。 请回答
请回答 下列问题:
下列问题: (1)Z2+ 的核外电子排布式是。
(1)Z2+ 的核外电子排布式是。 (2)在[Z(NH3)4]2+离子中,Z2+的空间轨道受NH3分子提供的形成配位键。
(2)在[Z(NH3)4]2+离子中,Z2+的空间轨道受NH3分子提供的形成配位键。 (3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是。
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是。 a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲<乙
a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲<乙 c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙 (4) Q、R、Y三种元素的第一电离能数值由小到大的顺序为(用元素符号作答)
(4) Q、R、Y三种元素的第一电离能数值由小到大的顺序为(用元素符号作答) (5)Q的一种氢化物分子中质子总数为14,其中分子中的σ键与π键的键数之比为。
(5)Q的一种氢化物分子中质子总数为14,其中分子中的σ键与π键的键数之比为。