向200mL 6mol·L-1盐酸中加入一定量的纯净CaCO3,产生气体的体积随时间的变化曲线如图所示(气体体积均在标准状况下测定)。
请回答下列问题:
(1)设OE段的反应速率为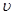 1,EF段的反应速率为
1,EF段的反应速率为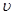 2,FG段的反应速率为
2,FG段的反应速率为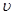 3,则
3,则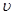 1、
1、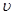 2、
2、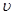 3从大到小的顺序为 。
3从大到小的顺序为 。
(2)为了减缓上述反应的速率,欲向该溶液中加入下列物质,你认为可行的是 (填字母)。
| A.蒸馏水 | B.氯化钾固体 |
| C.氯化钠溶液 | D.浓盐酸 |
(3)加入CaCO3的质量为 。
(4)若反应过程中溶液体积的变化忽略不计,则EF段用盐酸表示的化学反应速率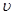 (HCl)= 。
(HCl)= 。
同素异形体相互转化的反应热相当少而且转化速率较慢,有时还很不完全,测定反应热很困难,现在可根据盖斯定律进行计算。
已知:P4(固体.白磷)+5O2(气体)= P4O10(固体) △H=-2983.2kJ·mol-1 ①
P(固体.红磷)+O2(气体)=P4O10(固体) △H=-738.5kJ·mol-1 ②
⑴由热化学方程式来看,更稳定的磷的同素异形体是
⑵试写出白磷转化为红磷的热化学方程式
(共4分) A、B、C、D都是中学化学常见的物质,其中A、B、C均含同一种元素。在一定条件下相互转化关系如下图所示(部分产物已略去)。请按要求回答下列问题: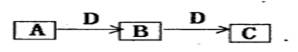
⑴若B、C为氧化物,B转化为C时,质量增加25%,C能够与水反应生成一种强酸,则B转化为C的化学方程式是:
⑵若D为某金属单质,向C的溶液中滴加硝酸银溶液,产生不溶于稀硝酸的白色沉淀,则B的化学式是
(共14分)下表中阿拉伯数字(1、2…)是元素周期表中行或列的序号。请参照元素A~J在周期表中的位置,回答下列问题:
| 纵行 横行 |
1 |
2 |
13 |
14 |
15 |
16 |
17 |
18 |
| 1 |
A |
|||||||
| 2 |
B |
C |
D |
|||||
| 3 |
F |
G |
H |
E |
I |
J |
⑴上表中元素的最高价氧化物对应的水化物中碱性最强的是_____________(用化学式表示)、酸性最强的是______________(用化学式表示);
⑵J的原子结构示意图为____________;C在周期表的第_________族;
⑶最高价氧化物对应的水化物能与其气态氢化物化合生成盐的元素是________;
⑷D、E、F、G四种元素简单离子的离子半径由大到小的顺序是(用化学符号表示)___________>____________>_____________>_____________;
⑸请设计一个简单的实验证明C元素的非金属性比B强(只写化学方程式)__________________
已知:2Fe3++2I-===2Fe2++I2
2Fe2++Br2===2Fe3++2Br-
(1)含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2,此时被氧化的离子
是_____________,被氧化的离子的物质的量分别是________。
(2)如果向原溶液中通入3 mol Cl2,则被氧化的离子是________,其对应的氧化产物的物质的量分别是_____________。
(3)若向含a mol FeI2和b mol FeBr2的溶液中通入c mol Cl2,当I-、Fe2+、Br-完全被氧化时,c________(用含a、b的代数式表示)。
已知A、B为气体单质,其中一种为黄绿色;D为常见金属单质,
C为化合物,它们之间有下列转化关系: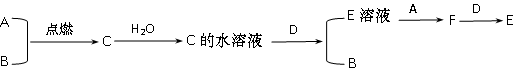
(1)试写出A、B、C、D的化学式:
A;B;C;D。
(2)写出C的水溶液与D反应的离子反应方程式:。
(3)F与D反应的离子反应方程式: ____。
(4)检验F中阳离子的试剂可以用:___________ ____,
现象:_____________________。