根据元素周期表和元素周期律,下列推断中错误的是
| A.砹是一种有色固体,它的气态氢化物很不稳定砹化银为有色沉淀且不溶解于稀硝酸,很容易分解 |
| B.在周期表中金属和非金属元素的分界线附近可以寻找半导体材料 |
| C.铷的硫酸盐易溶解于水,其氢氧化物一定是强碱 |
| D.溴化氢没有氯化氢稳定,其水溶液的酸性是盐酸>氢溴酸 |
对反应:A+B AB来说,常温下按以下情况进行反应
AB来说,常温下按以下情况进行反应
①20 mL溶液中含A、B各0.01 mol
②50 mL溶液中含A、B各0.05 mol
③0.1 mol·L-1的A、B溶液各10 mL
④0.5 mol·L-1的A、B溶液各50 mL
四种溶液反应速率的大小关系是
A.②>①>④>③ B.④>③>②>①C.①>②>④>③ D.①>②>③>④
将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应3A(g)+B(g)  xC(g)+2D(g),经5 min后测得D的浓度为0.5 mol·L-1,c(A)∶c(B)=3∶5,用C的浓度变化表示的平均反应速率为0.1 mol·L-1·min-1。下列有关结论正确的是
xC(g)+2D(g),经5 min后测得D的浓度为0.5 mol·L-1,c(A)∶c(B)=3∶5,用C的浓度变化表示的平均反应速率为0.1 mol·L-1·min-1。下列有关结论正确的是
A.x的值为1
B.用B的浓度变化表示的平均反应速率为0.2 mol·L-1·min-1
C.反应开始前A的物质的量为3 mol
D.5 min时A的浓度为0.2 mol·L-1
在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)  2SO3(g) ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
2SO3(g) ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是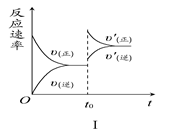
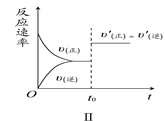

| A.图Ⅰ研究的是t0时刻增大O2的物质的量浓度对反应速率的影响 |
| B.图Ⅱ研究的是t0时刻通入氦气增大体系压强对反应速率的影响 |
| C.图Ⅲ研究的是催化剂对化学平衡的影响,且甲的催化效率比乙高 |
| D.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高 |
将4 mol A和2 mol B放入2 L密闭容器中发生反应:2A(g)+B(g)  2C(g) ΔH<0。4 s后反应达到平衡状态,此时测得C的浓度为0.6 mol/L。下列说法正确的是
2C(g) ΔH<0。4 s后反应达到平衡状态,此时测得C的浓度为0.6 mol/L。下列说法正确的是
A.4 s内,v(B)=0.075 mol/(L·s)
B.当c(A)∶c(B)∶c(C)=2∶1∶2时,该反应即达到平衡状态
C.达到平衡状态后,若只升高温度,则C的物质的量浓度增大
D.达到平衡状态后,若温度不变,缩小容器的体积,则A的转化率降低
下列物质中,不能使酸性KMnO4溶液褪色的物质是
①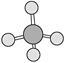 ②乙烯③CH3COOH
②乙烯③CH3COOH
④CH3CH2OH⑤CH2==="CH—COOH" ⑥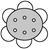
| A.①⑤ | B.①②④⑥ | C.①④ | D.①③⑥ |