(8分)用化学方程式或电离方程式解释下列有关实验现象:
(1)取少量的氯化铵晶体,放入试管中,在酒精灯火焰上微热,试管中出现白烟,试管口附近有“白霜”。
(2)向氨水中滴几滴酚酞试液,溶液变红色:
(3)一瓶无色气体打开瓶盖后,瓶口呈现出红棕色:
A、B、C、D、E、F六种物质的相互转化关系如右图所示。图中反应条件均未标出,部分产物(包括水)已略去,反应①是置换反应。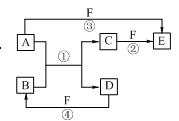
(1)若B、C、F都是气态单质,且B为黄绿色有毒气体。③和④两个反应中都有水生成,反应②需要放电才能发生。A、D均为极易溶于水的气态氢化物,且相遇有白烟生成。则A分子的立体构型为,反应③的化学方程式为 。
。
(2)若A、D为短周期元素的单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍。F是一种含氧酸,③和④两个反应中都有红棕色气体生成。则E的化学式为
 ,反应④的化学方程式为。
,反应④的化学方程式为。
按要求回答下列问题:
(1)已知在200℃,101kPa时,H2与碘蒸气作用生成1mol HI放出7.45kJ热量,则该反应的热化学方程式为。
(2)太阳能的开发和利用是21世纪一个重要课题。利用储能介质储存太阳能的原理是:白天在太阳照射下使某种盐熔化,吸收热量,晚间熔盐固化释放出相应能量。已知下列数据:
| 序号 |
盐 |
熔点/℃ |
熔化热/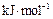 |
参考价格/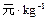 |
| ① |
CaCl2·6H2O |
29.0 |
37.3 |
780~850 |
| ② |
Na2SO4·10H2O |
32.4 |
77.0 |
800~900 |
| ③ |
Na2HPO4·12H2O |
36.1 |
100.1 |
1800~2400 |
| ④ |
Na2SiO3·5H2O |
52.5 |
49.7 |
1400~1800 |
其中最适宜作为储能介质的是。(选填物质序号)
(3)离子晶体晶格能的定义是气态离子形成1mol离子晶体释放的能量,通常取正值。现已知:
甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为: CO (g) + 2H2(g)  CH3OH (g)△H 1(反应1)
CH3OH (g)△H 1(反应1)
该反应的原料CO和H2本身都可作为燃料提供动力,已知这两种物质燃烧的热化学方程式为: △H2=-283 kJ·mol-1(反应2)
△H2=-283 kJ·mol-1(反应2)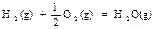 △H3=-242 kJ·mol-1(反应3)
△H3=-242 kJ·mol-1(反应3)
某些化学键的键能数据如下表:
| 化学键 |
C-C |
C-H |
H-H |
C-O |
C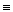 O O |
H-O |
| 键能/kJ·mol-1 |
348 |
413 |
436 |
358 |
1072 |
463 |
请回答下列问题:
(1)反应1的焓变△H1=。
(2)CH3OH (g)燃烧生成CO2( g)和H2O(g)的热化学方程式为:
g)和H2O(g)的热化学方程式为:
CH3OH(g)+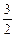 O2(g) ="=" CO2(g)+2H2O(g)△H4该反应的焓变△H4=。
O2(g) ="=" CO2(g)+2H2O(g)△H4该反应的焓变△H4=。
(3)反应1的平衡常数表达式为。
为提高甲醇的产率,可以采取的措施有(写出2点)。既能提高产率,又能提高反应速率的措施是。
(4)甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,该燃料电池的电池反应式为:CH3OH(l)+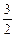 O2(g) ="=" CO2(g)+2H2O(l)。其工作原理示意图如下:
O2(g) ="=" CO2(g)+2H2O(l)。其工作原理示意图如下: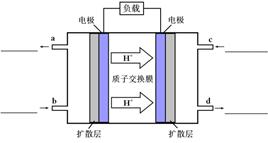
①在上图的横线上标出a、b、c、d四个出入口通入或排出的物质名称(或化学式)
②负极的电极反应式为。
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为:CrO42-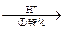 Cr2O72-
Cr2O72- Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓
其中第①步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
⑴若平衡体系的pH=2,该溶液显色。
⑵能说明第①步反应达平衡状态的是 。
。
a. Cr2O72-和CrO42-的浓度相同 b.2v(Cr2O72-)=v(CrO42-) c.溶液的颜色不变
⑶第②步中,还原1molCr2O72-离子,需要mol的FeSO4 7H2O。
7H2O。
方法2:电解法
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
⑷用Fe做电极的原因为。
⑸在阴极附近溶液pH升高的原因是(用电极反应解释),溶液中同时生成的沉淀还有。
⑹写出Cr2O72--变为Cr3+的离子方程式___________________;
A、B、C、D、E五种物质所含元素均有两种相同,且焰色反应均为黄色,B比A相对更稳定,C、D是工业上重要 的化工原料,也是实验室常用的药品,C、D在一定的条件下可相互转化,F与A、B、C、D在一定的条件下均可发生反应,它们的部分转化关系如下图(部分反应物或生成物省略)。
的化工原料,也是实验室常用的药品,C、D在一定的条件下可相互转化,F与A、B、C、D在一定的条件下均可发生反应,它们的部分转化关系如下图(部分反应物或生成物省略)。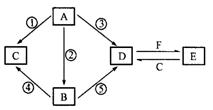
(1)B的电子式,C的俗名为。
(2)在①②③④⑤中,属于氧化还原反应的是。
(3)写出E溶液和C溶液反应的离子方程式:。
(4)写出D转化为C的化学方程式:。