现有①硫酸铜②碳酸钙固体③磷酸④硫化氢⑤三氧化硫⑥金属镁⑦石墨⑧苛性钾⑨NH3·H2O⑩熟石灰,其中(填序号)属于强电解质的是 ,属于弱电解质的是 ,属于非电解质的是 ,既不是电解质,又不是非电解质的是 。
对金属制品进行抗腐蚀处理,可延长其使用寿命。
(1)以下为铝材表面处理的一种方法: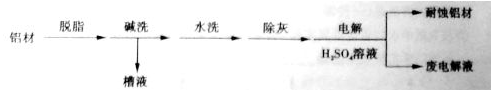
碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是______(用离子方程式表示)。为将碱洗槽液中的铝元素以沉淀形式回收,最好向槽液中加入下列试剂中的______。
a.NH3 b.CO2 c.NaOH d.HNO3
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的原因是 ______。
(3)利用右图装置,可以模拟铁的电化学防护。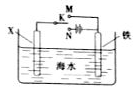
若X为碳棒,为减缓铁的腐蚀,开关K应置于______处。
若X为锌,开关K置于M处,该电化学防护法称为_______。
氯碱工业中电解饱和食盐水的原理示意图如图所示: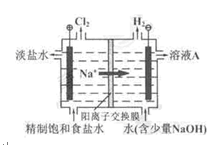
(1)溶液A的溶 质是;
质是;
(2)电解饱和食盐水的离子方程式是;
(3)电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用;
将足量BaCO3分别加入:① 30mL 水②10mL 0.2mol/LNa2CO3溶液③50mL 0.01mol/L 氯化钡溶液④100mL 0.01mol/L盐酸中溶解至溶液饱和。请确定各溶液中Ba2+的浓度由大到小的顺序为: _____
熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3、Na2CO3和的熔融盐混和物作电解质,CO为阳极燃气,空气与CO2的混和气为阴极助燃气,制得在650℃下工作的燃料电池,完成有关的电池反应式:电池反应式:阳极反应式:2CO+2CO32- →4CO2+4e-。
阴极反应式:,
电池总反应:。
海水中蕴藏着丰富的资源,海水综合利用的流程图如下。
(1)用NaC1做原料可以得到多种产品。
①工业上由NaC1制备58.5kg金属钠时,可生成标准状况下的氯气L。
②实验室用惰性电极电解氯化钠稀溶液可制备“84消毒液”,通电时产生的氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出相应的化学方程式。
(2)分离出粗盐后的卤水中蕴含丰富的镁资源,经转化后可获得MgC12粗产品。租产品的溶液中含有的Fe3+、Fe2+、Mn2+转化为沉淀除去;Fe(OH)3呈絮状,常将其转化为Fe(OH)3而除去(生成氢氧化物沉淀的pH见表)。
若只加入题(1)中得到的一种产品即可达到上述除杂目的,则该产品的化学式为,最终控制溶液的pH值为。MgC12粗产品在精制净化后,熔融、电解可得镁单质。环境专家认为可以用金属镁将水体中的NO3—还原为N2,从而消除污染。请补充完整以下离子方程式并配平:
NO3—+Mg+H2O=N2↑+Mg(OH)2+
(3)碘在地壳中主要以NaIO3形式存在,在海水中主要以,I—的形式存在。几种粒子之间有如下转化关系: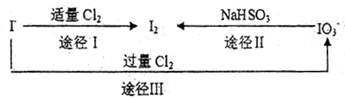
①如以途径I制取I2,加的、C12要适量;如过量就会发生途径Ⅲ的副反应,在该副反应产物中,IO3—。与C1—物质的量之比1:6,则氧化剂剂还原剂物质的量之比为。
②如以途径Ⅱ在溶液中制I2,反应后溶液显酸性,则反应的离子方程式是。