高锰酸钾是常用的氧化剂。工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体。下图是实验室制备的操作流程: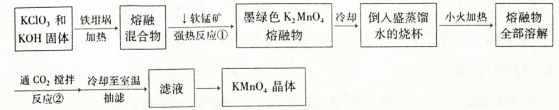
上述反应②的化学方程式: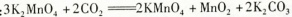
已知: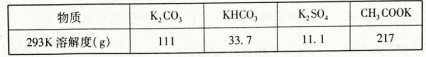
(1)加热软锰矿、KClO3和KOH固体时,不采用瓷坩埚而选用铁坩埚的理由是_______;
反应①的化学方程式为______。
(2)从滤液中得到KMnO4晶体的实验操作依次是________(选填字母代号,下同)。
A.蒸馏 B.蒸发 C.灼烧 D.抽滤 E.冷却结晶
(3)制备过程中需要用到纯净的CO2气体。制取纯CO2净最好选择下列试剂中_________。
A.石灰石 B.浓盐酸 C.稀疏酸 D.纯碱
(4)实验时,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低。原因是______ 。
(5)由于CO2的通人量很难控制,因此对上述实验方案进行了改进,即把实验中通CO2改为加其他的酸。从理论上分析,选用下列酸中________ ,得到的产品纯度更高。
A.醋酸 B.浓盐酸 C.稀硫酸
按要求回答下列问题
①写出Ba(OH)2溶于水时的电离方程式:
②写出工业生产氯气的化学方程式:
③写出Mg在CO2气体中点燃的化学方程式:
④写出钠和水反应的离子方程式:
已知CO和CO2的混合气体14.4g在标准状况下所占的体积为8.96L。则该混合气体中,CO的质量为g,CO2的物质的量为mol。
原子X核内质子数等于中子数,其阳离子Xn+核外共有a个电子,则X的质量数为。
①NaOH溶液 ②铜丝 ③液态HCl ④盐酸 ⑤酒精 ⑥液氨 ⑦氨水 ⑧SO2 ⑨ 胆矾晶体 ⑩熔融NaCl
(1)上述状态下可导电的是________________;
(2)属于非电解质的是___________;
(3)上述状态下的电解质不能导电的是____________________。
AgNO3的水溶液呈(填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示):;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以(填“促进”、“抑制”)其水解。