在2 L的密闭容器内,800℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K=______________。已知:K300℃>K350℃,则该反应是______热反应。
(2)下图表示NO2的变化的曲线是__________。用O2表示从0~2 s内该反应的平均速率v=___________。

(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a.及时分离出NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
下表是元素周期表的一部分。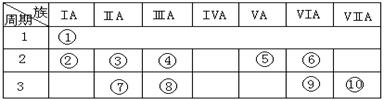
⑴下列说法正确且能说明元素⑩的非金属性比元素⑨强的是 。
| A.同温同压下,元素⑩的气态氢化物溶解度大于元素⑨的气态氢化物 |
| B.元素的最高价氧化物对应的水化物的酸性⑩强于⑨ |
| C.元素⑨和⑩的单质与铁反应分别得到低价、高价铁的化合物 |
| D.元素⑩的电负性大于元素⑨ |
⑵某元素原子的核外p电子数比s电子数少1,则该元素的元素符号是,与该元素单质分子互为等电子体的二价阴离子是。
⑶已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质。写出元素③的氢氧化物与盐酸反应的离子方程式:
。
⑷上述元素⑦形成的晶体对应的晶胞为下图中的___________________(填写序号)。
甲乙丙丁
⑸元素④的含氧酸的结构式可表示为 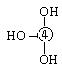 则可判断该酸为 酸(填强或弱)
则可判断该酸为 酸(填强或弱)
一分子该酸与水作用,只能产生1个H+,请写出该酸溶于水后溶液显酸性的离子方程式 。
⑹已知元素⑧气态氯化物的化学式为R2Cl6,结构式如下,试并标出其中的配位键 Cl Cl Cl
Cl Cl Cl
Al Al
Cl Cl Cl
有一无色透明溶液,欲确定是否含有下列离子:Na+、Mg2+、Al3+、Fe2+、Ba2+、NO 、SO
、SO 、Cl-、I-、HCO
、Cl-、I-、HCO ,进行如下实验:
,进行如下实验:
| 实验步骤 |
实验现象 |
| ①取少量原溶液,加几滴甲基橙 |
溶液变红色 |
| ②取少量原溶液,浓缩,加Cu片和浓H2SO4,加热 |
有无色气体产生,后在空气中又变成红棕色 |
| ③取少量原溶液,加BaCl2溶液 |
有白色沉淀生成 |
| ④取③中上层清液,加AgNO3溶液 |
有白色沉淀生成,且不溶于HNO3 |
| ⑤取少量原溶液,加NaOH溶液 |
有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
⑴溶液中肯定存在的离子是________________________;
⑵溶液中肯定不存在的离子是________________________;
⑶为进一步确定其他离子,应该补充的实验是_________ ________;
。
(1)食物中的营养物质主要包括:糖类、_______、蛋白质、维生素、无机盐、__________。
(2)迄今为止,煤、石油、_____________仍是人类使用的主要能源,它们同属于化石能源,是不可再生能源,需要合理开发利用。
(3)淀粉在稀酸的催化作用下,能最终水解为葡萄糖,欲检验淀粉是否完全水解,可以在水解反应混合物中滴加_______________溶液,通过溶液有没有发生显色反应来判断。
在2008年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1molXY2含有54mol电子。
(1)该融雪剂的化学式是 ;Y的最高价氧化物的水化物中含有的化学键是 。
(2)元素D原子的最外层电子数是其电子层数的2倍,且D与Y相邻;E是短周期最活泼的金属元素,试用电子式表示D与E组成化合物的形成过程为 。
(3)元素W与Y同周期,其氧化物可作为太阳能电子板的材料;元素Z的单质分子Z2中有3个共价键;W与Z能形成一种新型无机非金属材料,其化学式是_______________。
(4)W的氧化物是玻璃的主要成分,易与烧碱反应,该反应的化学方程式为:
_________________ ______________________。
取2.2g某饱和一元酸和饱和一元醇形成的液态酯,置于4LO2(足量)中,经点燃,酯完全燃烧,反应后气体体积减少0.56L,将反应后的气体经CaO充分吸收,体积又减少了2.24L(气体均为标准状况)
(1)该酯的分子中C、H、O的原子个数比为:。(必须写出计算过程)
(2)根据(1)C、H、O的原子个数比能否求出该酯的分子式(填“能”或“否”下同),原因是。
(3)若该酯的分子式已求出,能否确定该酯的结构,原因是 。
(4)若该酯是由等碳原子的饱和一元羧酸和饱和一元醇形成的,则该酯的结构简式为:。