已知:25℃时,H2SO3 Ka1=1.5×10﹣2 Ka2=1.0×10﹣7
H2CO3 Ka1=4.4×10﹣7 Ka2=4.7×10﹣11
HNO2 Ka=5.1×10﹣4 HClO Ka=3.0×10﹣8
饱和NaClO溶液的浓度约为3mol/L.
(1)室温下,0.1mol/L NaClO溶液的pH 0.1mol/L Na2SO3溶液的pH(选填“大于”、“小于”或“等于”).浓度均为0.1mol/L 的Na2SO3和Na2CO3的混合溶液中,SO32﹣、CO32﹣、HSO3﹣、HCO3﹣浓度从大到小的顺序为 。
(2)下列离子反应正确的有: .
A.2HCO3﹣+SO2═SO32﹣+2CO2+H2O B.ClO﹣+CO2+H2O═HClO+HCO3﹣
C.ClO﹣+SO2+H2O═HClO+HSO3﹣ D.2ClO﹣+SO2+H2O═2HClO+SO32﹣
(3)某消毒液的有效成分为NaClO,还含有一定量的NaOH等,下列用来解释事实的方程式中不合理的是: .
A.该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH﹣═Cl﹣+ClO﹣+H2O
B.室温下,该消毒液的pH约为12,主要是因为:ClO﹣+H2O HClO+OH﹣
HClO+OH﹣
C.该消毒液加白醋生成HClO,可增强漂白作用:H++ClO﹣═HClO
D.该消毒液与洁厕灵(主要成分为HCl)混用,产生Cl2:2H++Cl﹣+ClO﹣═Cl2↑+H2O
(4)25℃时,0.1mol下列气体分别与1L0.l mol·L﹣1的NaOH溶液反应(已知2NO2+2NaOH═NaNO2+NaNO3+H2O),形成的溶液的pH由大到小的顺序为: (用A、B、C、D表示).
A.NO2 B.SO3 C.SO2 D.CO2.
(5)下列说法不正确的是( )
A.在相同温度下将pH相同的稀硫酸和醋酸溶液等体积混合,所得混合液的pH与原来相同。
B.含等物质的量的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO﹣)=c(HCO3﹣)+c(H2CO3)+c(CO32﹣)
C.CH3COOH溶液加水稀释后,溶液中c(H+)/C(CH3COO-)的值减小
(6)已知某温度下,0.10mol/LNH4Cl溶液的PH=5,则该温度下NH3·H2O的电离常数约为 。
已知在强碱溶液中加热R-Br 容易水解为R-OH,现知某芳香烃A有如下转化关系: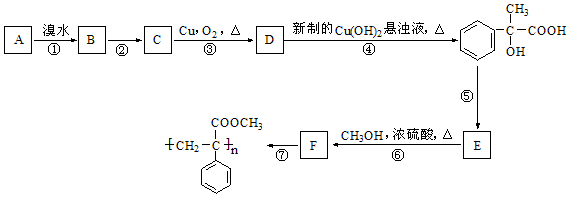
按要求填空:
(1)写出反应②和⑤的反应条件:② ;⑤
(2)写出A和F结构简式:A ;F
(3)写出反应①和⑥的类型:① ;⑥
(4)写出反应③、⑦对应的化学方程式:
③
⑦
新合成的一种烃,其碳架呈三棱柱体(如图所示)
(1)写出该烃的分子式。
(2)该烃的一氯取代物是否有同分异构体。
(3)该烃的二氯取代物有多少种。
(4)该烃的同分异构体有多种,其中1种不能使酸性高锰酸钾溶液或溴水溶液褪色,但在一定条件下能跟溴发生取代反应、与H2发生加成反应,这种同分异构体的结构简式是。
已知乙烯能发生以下转化: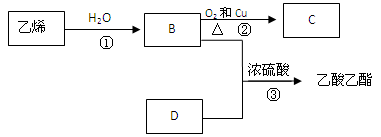
(1)乙烯的结构简式为: 、空间构型为___________.
(2)写出B、D化合物中官能团:B中含官能团;D中含官能团;
(3)写出反应的化学方程式
①反应类型:
②反应类型:
Ⅰ、已知在101 kPa时,CH4完全燃烧生成1mol液态水,放出的热量为QkJ,则CH4完全燃烧反应的热化学方程式是:。
Ⅱ、在铜片、锌片和400 mL稀硫酸组成的原电池中,若电路中通过0.2 mol电子,H2SO4恰好反应完毕。试计算:
(1)生成气体的体积(在标准状况下);
(2)原400 mL稀硫酸的物质的量浓度(不考虑溶液的体积变化)。
氢气是未来最理想的能源之一,科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术:2H2O 2H2↑+O2↑。制得的氢气可用于燃料电池。
2H2↑+O2↑。制得的氢气可用于燃料电池。
试回答下列问题:
(1)海水分解生成的氢气用于燃料电池时,实现________能转变为________能。水分解时,断裂的化学键为________键,分解海水的反应属于________反应(填“放热”或“吸热”)。
(2)某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应分别为:A极:2H2+2O2--4e-===2H2O;B极:O2+4e-===2O2-,则A极是电池的______极;电子从该极________(填“流入”或“流出”)。
(3)有人以化学反应:2Zn+O2+4H+===2Zn2++2H2O为基础设计出一种原电池,移入人体内作为心脏起搏器的能源,它们靠人体内血液中溶有一定浓度的O2、H+、Zn2+进行工作。则原电池的负极材料是______,正极上发生反应的电极反应式为。