北京时间2013年12月2日凌晨1时30分,我国的“嫦娥三号”月球探测器在西昌卫星发射中心发射升空,发射“嫦娥三号”月球探测器的火箭推进器中装有还原剂肼(N2H4)和氧化剂N2O4,当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热。已知0.4 mol气态肼和足量N2O4气体反应生成氮气和水蒸气时放出219.3 kJ的热量。
(1)写出肼和N2O4反应的热化学方程式: ;
(2)已知H2O(l)=H2O(g) ΔH=+44 kJ·mol-1,则16 g气态肼与足量N2O4气体反应生成氮气和液态水时,放出的热量是 ;
(3)肼除应用于火箭燃料外,还可作为燃料电池的燃料,由肼和空气构成的碱性燃料电池的负极反应式为: ,正极反应式为: ;
(4)向次氯酸钠溶液中通入一定物质的量的氨气可生成肼,写出反应的离子方程式: 。
写出下列物质的电子式:
KCl K2O
N2 CS2
CS2
H2S分子的形成过程:_________________________________.
MgCl2分子的形成过程:_________________________________.
由短周期元素组成的A、B、C、D、E、F六种微粒,其中只有C、D是分子,其余四种均为带一个单位正电荷的阳离子或一个单位负电荷的阴离子,且每个微粒中都含有10个电子。已知A、E是由非金属元素组成的阳离子,六种微粒间有下列关系:
①A++B-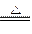 C+D, B-+E+=2
C+D, B-+E+=2 D;
D;
②通常情 况下,C是一种无色刺激性气味的气体,且可使湿润的红色石
况下,C是一种无色刺激性气味的气体,且可使湿润的红色石 蕊试纸变蓝;
蕊试纸变蓝;
③向含F离子的溶液中加入C的水溶液,可生成白色沉淀W,C溶液过量沉淀也不消失。再加入含大量B离子或大量E离子的溶液时,沉淀W在其中一种情况下溶解,另一种情况下不溶解。
请回答下列问题:
(1)微粒A的名称及化学式分别为、。
(2)C的水溶液中存在的分子总数至少有种。
(3)写出微粒F与过量C的水溶液反应的离子方程式:。
(4)向含有0.1mol F离子的50mL溶液中,加入含1.5mol/L B离子的200mL强碱溶液,结果有白色沉淀产生,再向该混合物中加入含1mol/L E离子的强酸溶液,若要使沉淀恰好溶解,则最后加入的溶液的体积至少为mL。
若以X、 Y和Z代表三种不同周期的短周期元素,其原子序数依次增大。且知:X与Y可形成原子个数比分别为1∶1的共价化合物甲和2∶1的共价化合物乙;Y与Z可形成原子个数比分别为1∶1的离子化合物丙和2∶1的离子化合物丁。请回答:
Y和Z代表三种不同周期的短周期元素,其原子序数依次增大。且知:X与Y可形成原子个数比分别为1∶1的共价化合物甲和2∶1的共价化合物乙;Y与Z可形成原子个数比分别为1∶1的离子化合物丙和2∶1的离子化合物丁。请回答:
(1)元素Y在周期表中的位置为:第周期、第族。
(2)化合物甲的结构式是。
(3)化合物丙中的化学键类型有。
(4)Y的阴离子半径与Z的阳离子半径大小关系为:r(Yn-)r(Zm+)。
A、B、C均为短周期元素,在元素周期表中的相对位置如下图所示,A、C两种元素的原子核外电子数之和等于B原子的核电荷数。请完成下列填空: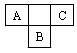
(1)A的原子结构示意图为,A的最高价氧化物对应水化物的的分子式为。
(2)B的简单离子的电子式为。
(3)用电子式表示C的氢化物分子的形成过程: 。
。
(4)C单质与水反应的化学方程式为。
下表列出了A~R等9种元素在元素周期表中的位置:
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
E |
F |
||||||
| 3 |
A |
C |
D |
G |
R |
|||
| 4 |
B |
H |
请按要求用相应的化学用语回答下列问题:
(1)写出下列元素的元素符号:A;E;G。
(2)上述9种元素中,性质最不活泼的元素的一种同位素的原子核内有20个中子,则表示该同位素原子的符号为。
(3)A、C、 D三种元素按金属性由强到弱的顺序排列为。
D三种元素按金属性由强到弱的顺序排列为。
(4)F单质的电子式为。
(5)D元素的最高价氧化物对应的水化物与KOH溶液反应的离子方程式为
。