下图所示的是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质和反应条件被略去。化合物A是家庭生活中常用的一种调味品,反应①称之为“氯碱工业”。D是黄绿色气体,H的水溶液具有漂白、杀菌性,J为红褐色沉淀。
(1)H的化学式为 。
(2)写出I与Fe反应生成G的离子方程式为 。
(3)反应①的化学方程式为 。
(4)反应②的离子方程式为 。
钠是活泼金属的代表,钠和钠的化合物是中学化学的基础知识。请回答下列有关问题。
(1)钠跟水剧烈反应,生成和氢气(H2),此实验说明钠的化学性质活泼;
(2)钠有两种氧化物,其中能用于呼吸面具和潜水艇中作为氧气来源的氧化物是;
(3)固体碳酸钠中含有碳酸氢钠杂质,除去此杂质的简单方法是(填“萃取”或“加热”或“蒸馏”)。
根据乙烯和乙醇的知识填空。
(4)完成下列化学方程式:CH2= CH2+  CH3CH2OH;
CH3CH2OH;
(5)实验室,乙醇跟乙酸在浓硫酸催化且加热的条件下反应,制取的有机物是。
现有以下四种物质:
| A.新制的氢氧化铜[Cu(OH)2]悬浊液 | B.碳铵(NH4HCO3) |
| C.明矾[KAI(SO4)2·12H2O] | D.熟石灰[Ca(OH)2] |
请你根据题意,选择恰当的选项用字母代号填空。
(1)检验尿液中是否含有葡萄糖,可使用;
(2)要使含泥沙的洪水变澄清,可使用;
(3)要中和钢铁厂、电镀厂产生的酸性废水,可使用;
(4)给农作物施用氮肥,可使用。
铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如图所示: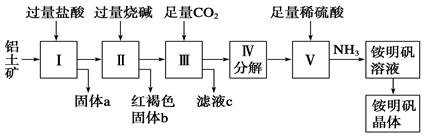
请回答下列问题:
(1)固体a的化学式为________。
(2)由图中Ⅴ制取铵明矾溶液的化学方程式为_____,从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)________、冷却结晶、过滤洗涤。
(3)以1 000 kg含氧化铝36%的铝土矿为原料制取Al2(SO4)3,需消耗质量分数为98%的硫酸(密度1.84 g·cm-3)________ L(保留一位小数)。
(4)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1∶1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为________。
(共10分)镁及其合金是一种用途很广的金属材料,海水中镁的含量为1.10 mg·L-1,目前世界上60%的镁是从海水中提取的。主要步骤如下: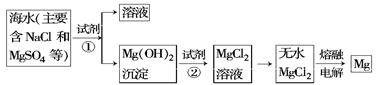
(1)为了使MgSO4完全转化为Mg(OH)2,可以加入过量试剂①,试剂①最好选用______。(填写名称)
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的操作方法是____________。
(3)试剂②可以选用________,其反应的离子方程式为_______________。
(4)无水MgCl2在熔融状态下,通电后会产生Cl2和Mg,写出该反应的化学方程式________________。
(共4分)已知在Ca3(PO4)2的饱和溶液中存在平衡:
Ca3(PO4)2(s)  3Ca2+(aq)+2PO43-(aq)
3Ca2+(aq)+2PO43-(aq)
(1)溶度积Ksp=______________________;
(2)若一定温度下,饱和溶液中c(Ca2+)=2.0×10-6 mol·L-1,
c(PO43-)=1.58×10-6 mol·L-1,则Ksp=________________。