(共4分)已知在Ca3(PO4)2的饱和溶液中存在平衡:
Ca3(PO4)2(s)  3Ca2+(aq)+2PO43-(aq)
3Ca2+(aq)+2PO43-(aq)
(1)溶度积Ksp=______________________;
(2)若一定温度下,饱和溶液中c(Ca2+)=2.0×10-6 mol·L-1,
c(PO43-)=1.58×10-6 mol·L-1,则Ksp=_______ _________。
下表是元素周期表的一部分,完成下列有关问题:
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
① |
② |
||||||
| 3 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
|
| 4 |
⑩ |
11 |
12 |
(1)写出下列元素符号:①________________,⑥________________,⑦________________。
(2)在这些元素中,最活泼的金属元素是________________,最活泼的非金属元素是________________,最不活泼的元素是________________。
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是________________,碱性最强的是________________,呈两性的氢氧化物是________________,写出三者之间相互反应的化学方程式。
(4)在这些元素中,原子半径最小的是________________,原子半径最大的是________________。
(5)在③与④中,化学性质较活泼的是________________,怎样用化学实验证明?答:________________________________________________________________。
在⑧与12中,化学性质较活泼的是________________,怎样用化学实验证明?答:________________________________________________________________。
(6分)已知:A、B、C、D分别是中学化学中常见的四种不同粒子,它们之间有如下的反应关系:
(1)如果A、B、C、D均是10电子粒子,请写出:A的化学式______________。
(2)如果A和C是18电子的粒子,B和D是10电子粒子,请写出:
①A与B在溶液中反应的离子方程式:_________________________________________。
②根据上述离子方程式,可以判断C与B结合质子的能力大小是(用化学式或离子符号表示):______________>______________。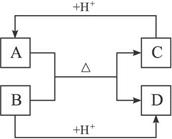
X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:
①元素周期表中,Z与Y相邻,Z与W也相邻;
②Y、Z和W三种元素的原子最外层电子数之和为17。
请填空:
(1)Y、Z和W三种元素是否位于同一周期(填“是”或“否”):________________,理由是________________________________________________________________________________________________________________________。
(2)Y是________________,Z是________________,W是________________。
(3)X、Y、Z和W可组成一化合物,其原子个数之比为8∶2∶4∶1。写出该化合物的名称及化学式____________________________________________________。
已知:A、B、C、D分别是中学化学中常见的四种不同粒子,它们之间有如下的反应关系: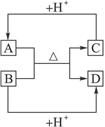
(1)如果A、B、C、D均是10电子粒子,请写出:A的化学式___________________。
(2)如果A和C是18电子的粒子,B和D是10电子粒子,请写出:
①A与B在溶液中反应的离子方程式:___________________________________________。
②根据上述离子方程式,可以判断C与B结合质子的能力大小是(用化学式或离子符号表示):___________________>___________________。
(8分)有几种元素粒子的核外电子层结构如图所示: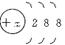
(1)某电中性粒子一般不和其他元素的原子反应,这种粒子的符号是______________。
(2)某粒子的盐溶液,能使溴水褪色,并出现浑浊,这种粒子的符号是_________________。
(3)某粒子氧化性甚弱,但得到电子后还原性很强,且这种原子有一个单电子,这种粒子的符号是______________________。
(4)某粒子还原性虽弱,但失电子后氧化性很强,且这种原子得一个电子即达稳定结构,这种粒子的符号是______________________。