碘及其化合物在人类活动中占有重要地位。
(1)加碘食盐中含有碘酸钾(KIO3),工业上以电解法制备碘酸钾,电解设备如图所示。先将一定量的碘溶于过量氢氧化钾溶液,发生反应: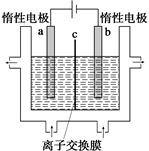
3I2+6KOH=5KI+KIO3+3H2O,再将该溶液加入 (阴极、阳极)区,另将氢氧化钾溶液加入另外一个区。使用 (阴、阳)离子交换膜,在阳极发生的电极反应式: 。
(2)碘化氢不稳定,分解反应的热化学方程式是2HI(g)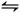 I2(g)+H2(g) ΔH="+9.48" kJ·mol-1已知ΔS>0
I2(g)+H2(g) ΔH="+9.48" kJ·mol-1已知ΔS>0
①该反应属于( )
A.任何温度均自发 B.任何温度均不自发 C.高温自发 D.低温自发
②一定条件下,反应在一个带有活塞的密闭容器中达到平衡,下列说法中不正确的是( )
A.恒温,缩小体积,平衡常数不变
B.恒温,缩小体积,平衡不移动,颜色加深
C.恒容,升温,正向反应速率和逆向反应速率均增大
D.恒容,在容器中若投入2mol HI,达到平衡时吸收9.48 kJ 的热量
③一定温度下,平衡常数K=1/4,在2L的容器中,加入4molHI发生反应达到平衡,HI的转化率 。
对一份白色固体,经过初步分析得知,其含有Na2CO3、Na2SO4、NaCl、CuSO4等物质中的一种或几种。甲乙两位同学为了进一步确定这份白色固体的组成成份而进行了如下实验,但实验中的有些问题还需你来作答。
(1)甲取少量白色固体在试管内用水溶解,结果得无色澄清的液体。因此,甲说肯定有一种物质不存在。这种物质的化学式是:______________
(2)甲又先后向那试管内加入了稍过量的BaCl2溶液和稀硝酸,结果是先产生了白色沉淀,后又有一部分沉淀消失并从溶液里冒出无色气泡。因此甲又说肯定有两种物质存在。这两种物质是:______________、_____________。
(3)乙将甲所得混合物进行了过滤,取滤液约2ml盛于另一支洁净的试管里,然后又向该试管内加入了稍过量的AgNO3溶液和稀硝酸,结果也产生了白色沉淀。因此乙说那份白色固体中也肯定有NaCl。你说乙的结论(填“对”或“不对”)__________,理由是:________________
、
、
、
、
是短周期元素,周期表中
与
、
与
相邻;
与
的最外层电子数之比为2∶3,
的最外层电子数比
的最外层电子数少1个;常见化合物
与水反应生成
的单质,且溶液使酚酞试液变红.
(1)
的元素符号是.
(2)
、
、
的氢化物稳定性顺序为(用分子式表示);
的氢化物和
的最高价氧化物的水化物反应生成
,则
中的化学键类型为,
的晶体类型为;
离子的电子式为.
(3)由
、
、
形成化合物的水溶液显碱性,其原因是(用离子方程式表示).
(4)一定量的
与
反应后的固体物质,恰好与0.8
稀盐酸溶液完全反应,并收集到0.25
气体,则用物质的量表示该固体物质的组成为.
有机物
、
、
互为同分异构体,分子式为
,有关的转化关系如题28图所示,已知:
的碳链无支链,且1
能与4
完全反应;
为五元环酯.
(1)
中所含官能团是.
(2)
、
结构简式为.
(3)写出下列反应方程式(有机物用结构简式表示)
;
.
(4) 的加聚产物的结构简式为.
脱除天然气中的硫化氢既能减少环境污染,又可回收硫资源.
(1)硫化氢与
溶液反应生成单质硫,其离子方程式为.
(2)用过量
溶液吸收硫化氢后,以石墨作电极电解该溶液可回收硫、其电解总反应方程式(忽略氧的氧化还原)为;该方法的优点是.
(3)一定温度下1
固体在定容真空容器中可部分分解为硫化氢和氨气.
①当反应达平衡时
氨气×
硫化氢=
,则容器中的总压为
;
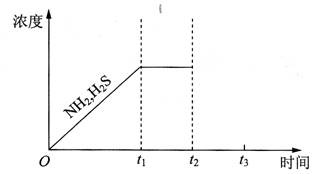
②题26图是上述反应过程中生成物浓度随时间变化的示意图.若
时增大氨气的浓度且在
时反应再次达到平衡,诸在图上画出
时刻后氨气、硫化氢的浓度随时间的变化曲线.
黄铁矿主要成分是
。某硫酸厂在进行黄铁矿成分测定时,取0.1000
样品在空气中充分灼烧,将生成的
气体与足量
溶液完全反应后,用浓度为0.02000
的
标准溶液滴定至终点,消耗
溶液25.00
。
已知:
(1)样品中 的质量分数是(假设杂质不参加反应)
(2)若灼烧6 产生的 全部转化为 气体时放出9.83 热量,产生的 与水全部化合生成 ,放出13.03 热量,写出 气体转化为 的热化学方程式:
(3)煅烧10 上述黄铁矿,理论上产生 的体积(标准状况)为 ,制得98%的 , 全部转化为 时放出的热量是 。