在温度为298K时,将0.10 mol无色的N2O4气体放入1L抽空的密闭容器中,出现红棕色,直至建立N2O4(g) 2NO2(g)的平衡。下图表示测定N2O4的浓度与时间关系的曲线(纵坐标为N2O4的浓度,横坐标为时间)。
2NO2(g)的平衡。下图表示测定N2O4的浓度与时间关系的曲线(纵坐标为N2O4的浓度,横坐标为时间)。
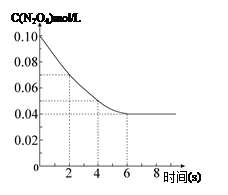
|
(1)计算在2s至4s时间内,NO2的平均生成速率为 。
(2)若在相同情况下最初向该容器充入的是二氧化氮气体,要达到同样的平衡状态,二氧化氮的起始浓度是 mol·L-1。| T/K |
310 |
320 |
| K值 |
0.38 |
0.42 |
据此判断该反应正反应是 反应(填“吸热”或“放热”)
(6)若其他条件不变,反应在398K条件下进行并达到平衡,此温度下N2O4的浓度随时间变化的曲线(以298K条件下进行并达到平衡的曲线作为参照)正确的是 ( )
(11分)某温度时,在2 L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
(1)根据下表中数据,画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:(3分)
(2)体系中发生反应的化学方程式是_____________________________;(3分)
(3)列式计算该反应在0 min~3 min时间内v(Z)="=" ________________________________;(保留至小数点后三位)(3分)
(4)该反应达到平衡时反应物X的转化率等于______________________。(2分)
(15分)A、B、C、D、E、F、G是核电荷数依次增大的短周期主族元素。元素A的原子半径是所有元素中最小的。A、D同主族,B、C同周期,C、F最外层电子数相等,F的质量数为C的2倍,元素B的一种常见单质可做惰性电极材料,其最高价氧化物甲为常见温室气体。B、C、F的质子数之和等于E、G的质子数之和。
(1)由A、B、C、D四种元素组成的一种常见化合物乙是__________________(填写化学式);(2分)
(2)由C、D、E三种元素组成的一种化合物丙是____________(填写化学式);(2分)
(3)G单质与水反应的离子方程式为_________________________________________;(3分)
(4)书写甲的电子式____________________________(2分)
(5)A2C和A2F中,沸点较高的是(填化学式)(1分),
液态A2C汽化需要破坏微粒间的作用是______________________(2分)
(6)少量甲通入丙溶液中的离子方程式是__________________________________;(3分)
(14分)下面是18×7的格子,按要求作答。
| A |
He |
||||||||||||||||
| C |
D |
||||||||||||||||
| E |
F |
H |
|||||||||||||||
(1)用封闭的实线绘出元素周期表的轮廓。注意:不得使用铅笔作图。(3分)
(2)“大爆炸理论”指出:200亿年以前,宇宙中所有物质都包含在一个密度无限大,温度无限高的原始核中,由于某种原因它发生了爆炸,首先产生了中子、质子和电子,随后就产生了元素。你由此可知最先产生的元素是_______(填写元素名称)(1分),其中子数比质子数多1的核素的原子符号是_________;(1分)
(3)C、D、E、F的简单离子半径由小到大顺序是_______________________(填写离子符号);(2分)
(4)请用电子式表示出E和H形成的化合物形成过程:_____________________________;(2分)
(5)用实线绘出金属与非金属的分界线。注意:不得使用铅笔作图。(2分)
(6)用来组成酸、碱、盐三类物质至少需要的元素有__________(填写表中字母)。(3分)
A、B、C三种强电解质,它们溶于水在水中电离出的阳离子有K+、Ag+,阴离子有NO3-、OH-(电解质电离的离子有重复)。
图1装置中,甲、乙、丙三个烧杯中依次盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为铂电极。接通电源,经过一段时间后,测得甲中b电极质量增加了43.2g。常温下各烧杯中溶液pH与电解时间t关系如图2。请回答下列问题: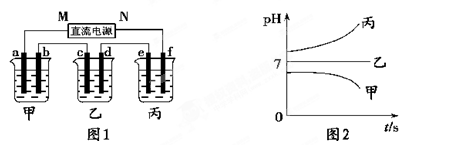
(1)写出三种强电解质的化学式:A;B;C。
(2)写出乙烧杯c电极发生的电极反应为__________________________,甲烧杯中的总反应的化学方程式为___________________________________________。
(3)计算丙烧杯e电极上生成的气体在标准状况下的体积为________________,甲烧杯中溶液的pH=。(假设溶液体积是400ml)
(4)要使甲烧杯中的A溶液恢复到电解前的状态,需要加入的物质是_____________,其质量为。
(5)若直流电源使用的是铅蓄电池,铅蓄电池的正极材料是PbO2,负极材料是Pb,电解质溶液时H2SO4,则放电时N级上发生的电极反应为________________________________
____________________,M级附近溶液的pH(选填“升高”或“降低”或“不变”)。
铅蓄电池充电时,若阳极和阴极之间用阳离子交换膜(只允许H+通过)隔开,则当外电路通过0.2mol电子时,由阳极室通过阳离子交换膜进入阴极室的阳离子有mol。
工业上制氯化铜无水物时,是将浓盐酸用蒸气加热至80 ℃左右,慢慢加入粗制氧化铜粉(含杂质氧化亚铁和SiO2),充分搅拌后使之溶解,制取流程如下: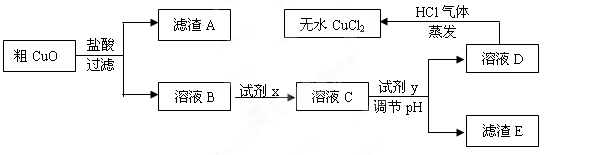 已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;常温时Ksp[Fe(OH)3]=c(Fe3+).c3(OH-)=1.0×10-38。试回答:
已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;常温时Ksp[Fe(OH)3]=c(Fe3+).c3(OH-)=1.0×10-38。试回答:
(1)根据常温时Fe(OH)3的Ksp计算,当溶液中的Fe3+完全沉淀(此时溶液中的Fe3+物质的量的浓度=10-5mol/L),溶液的pH=。
(2)溶液D制取无水CuCl2时,需在HCl气体中蒸干,原因是
。
(3)粗CuO溶于过量盐酸后,得到的溶液B中加入试剂x将Fe2+氧化为Fe3+,试剂x可以是(填以下选项序号)。
A.KMnO4溶液 B.氯水 C.NaClO溶液 D.O3
若用H2O2溶液,则反应的离子方程式为。
(4)溶液C加入试剂y,要调整溶液的pH至3-4,试剂y不能是(填以下选项序号),原因是。
A.NaOH溶液 B.Cu(OH)2固体 C.Cu2(OH)2CO3固体 D.CuO固体
(5)将ag粗CuO经过以上一系列操作之后,最终得到bg无水CuCl2(不考虑实验过程中操作引起的损耗),下列说法正确的是。(NA表示阿伏伽德罗常数)
A.粗CuO中Cu2+数目小于
B.粗CuO中CuO物质的量小于 mol
mol
C.粗CuO中所含的铜元素的质量分数为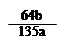 ×100℅
×100℅
D.粗CuO中关于CuO的量无法确定