(12分) 水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。根据下列信息回答问题:
(1)基态氧原子价层电子的电子排布图为____________
(2)写出两种与H2O分子互为等电子体的微粒 、
(3)下列关于水的说法正确的是__________(选填序号)。
A、纯水呈中性,所以在任何条件下纯水的pH均为7;
B、水分子是由极性键构成的极性分子;
C、水在化学反应中可以作氧化剂,也可以作还原剂;
D、水分子中既含σ键,又含有π键;
(4)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是
A.氧原子的杂化类型发生了改变 B.微粒的空间构型发生了改变
C.微粒的化学性质发生了改变
(5)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是 (请用相应的编号填写)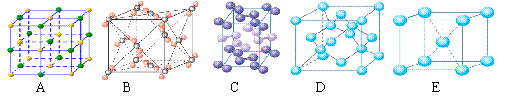
(6)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol;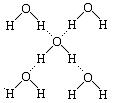
(7)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子。请写出生成此配合离子的离子方程式: 。
有A、D、E、G、M、L六种前四周期的元素。A是宇宙中最丰富的元素。D原子核外有1个未成对电子,D+比E原子少一个电子层,E原子得一个电子填入3p轨道后,3p轨道呈全充满状态。G原子的2p轨道有2个未成对电子,M的最高化合价和最低化合价的代数和为4,与G的原子序数相差8。L位于周期表第12纵行且是六种元素中原子序数最大的。R是由M、L形成的化合物,其晶胞结构如图所示。请回答下列问题:
(1)E元素的电负性________M元素的电负性(填“>”、“<”或“=”)。
(2)G的第一电离能比它同周期前一族相邻元素的第一电离能________(填“大”或“小”)。
(3)E-的最外层共有______种不同运动状态的电子,最外层电子分属______个能级。M2E2广泛用于橡胶工业,在该化合物分子中,所有原子最外层均满足8电子稳定结构。则在M2E2分子中M原子的杂化类型是__________,M2E2是_________分子(填“极性”或“非极性”)。
(4)M和G形成的一种化合物分子式为MG2,该分子的VSEPR模型为__________,分子的空间构形为___________。
(5)L的价电子排布式为_________,该元素位于周期表中_____族。
(6)R的化学式为________(用元素符号表示),属于_______晶体。已知R晶体的密度为ρ g•cm-3,则该晶胞的边长a="_____________" cm,(阿伏加德罗常数用NA表示)。
铝是人类生活中继铜、铁之后又一个重要的金属。工业上冶炼金属铝的原料来源于自然界中重要的矿物质钒土(主要成分:Al2O3;还有SiO2、Fe2O3、FeCO3、MgCO3等杂质)。从钒土中提取得到Al2O3的工艺流程如下图所示:
请回答下列问题:
(1)固体A所含物质的化学式(或分子式)是_____________________________。
(2)写出溶液A与气体B反应的离子方程式________________________________。
(3)工业冶炼金属铝通常用石墨碳块作电解槽的阳极,请你根据电解原理解释电解冶炼铝过程中,需要定期补充阳极碳块的原因____________________________。
(4)Al2O3的熔点很高,因而在工业冶炼时,需将Al2O3的熔于熔化的冰晶石(Na3AlF6)中进行电解。有一位同学查阅资料发现,AlCl3的熔点很低。他提出:可通过电解熔融状态的AlCl3制取金属铝。你认为他提出的方案是否可行?为什么?______________________________________________。
(5)另一位同学分析了“从钒土中提取Al2O3的工艺流程”后指出:可以从“溶液B”中分离得到另一个重要的化工产品——小苏打。根据这位同学的想法,如果不考虑生产过程的损耗,请你计算每生产10.0t金属铝,理论上可得到小苏打产品___________t。
要配制450mL 0.2mol•L-1FeSO4溶液,实验操作步骤有:①在天平上称取a g绿矾(FeSO4•7H2O),将它放在烧杯中,用适量蒸馏水使其完全溶解 ②将所得溶液沿玻璃棒注入500mL容量瓶中③继续向容量瓶中加水至液面距刻度线1–2cm处,改用胶头滴管滴加蒸馏水至凹液面底部与刻度线相切④用少量水洗涤烧杯和玻璃棒2-3次,每次洗液都转入容量瓶⑤将容量瓶塞紧,充分摇匀
填写下列空白
(1)a g绿矾的实际质量为____________g。
(2)上述操作步骤的正确顺序为__________________。
(3)下列操作会使所配溶液的浓度偏高的是__________。
| A.若配制时遗漏步骤④; | B.定容时俯视刻度线; |
| C.称量时物、码放反了; | D.绿矾样品已部分风化 |
E.摇匀后溶液低于刻度线,再加入蒸馏水使液面最低点与刻度线相切;
F.引流时玻璃棒靠在刻度线上方
(4)取一定体积所配制硫酸亚铁的溶液,用一定浓度的酸性KMnO4标准溶液进行滴定,滴定过程中______(需要或不需要)指示剂,并说明理由_________________________________________。
Ⅱ. 三氟化氮(NF3)是一种新型的电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其生成物有HF、NO、HNO3。根据要求回答下列问题:
(1)写出该反应的化学方程式:_________________________________________。反应过程中,被氧化与被还原的元素物质的量之比为______。
(2)若反应中生成0.2mol HNO3,转移的电子数目为______。
I:工业制硫酸时,利用接触氧化反应将SO 2转化为SO 3是一个关键步骤 。
(1)某温度下,2SO 2(g)+O 2(g) 2SO 3(g) △H="-197" kJ/mol。开始时在10 L的密闭容器中加入8.0 mol SO 2(g)和20.0 mol O 2(g),当反应达到平衡时共放出394kJ的热量,该温度下的平衡常数K= (保留两位有效数字),若升高温度时,K将 (填“增大、减小或不变”)。
2SO 3(g) △H="-197" kJ/mol。开始时在10 L的密闭容器中加入8.0 mol SO 2(g)和20.0 mol O 2(g),当反应达到平衡时共放出394kJ的热量,该温度下的平衡常数K= (保留两位有效数字),若升高温度时,K将 (填“增大、减小或不变”)。
(2)若体积不变的条件下,下列措施中有利于提高SO2的转化率条件是______(填字母)。
A.通入氧气 B.移出氧气 C.增大压强 D.减小压强 E.加入催化剂
(3)在硫酸工业生产过程中,有反应2SO2(g)+O2(g) 2SO3(g)(正反应为放热反应),根据下表提供的不同条件下SO2的转化率(%)的数据,试选择该反应的适宜条件(以V2O5作催化剂)温度____________;压强____________。
2SO3(g)(正反应为放热反应),根据下表提供的不同条件下SO2的转化率(%)的数据,试选择该反应的适宜条件(以V2O5作催化剂)温度____________;压强____________。
(4)能判断该反应达到平衡状态的依据是___________。
A. 容器的压强不变
B. 混合气体的密度不变
C. 混合气体中SO 3的浓度不变
D. C(SO 2)=C(SO 3)
E. v 正(SO 2)="v" 正(SO 3)
F. v 正(SO 3)="2v" 逆(O 2)
II:研究化学反应原理对于生产生活是很有意义的。
(1)在0.10mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=________________mol·L-1(Ksp[Cu(OH)2]=2.2×10-20)。
(2)若在0.1mol·L-1硫酸铜溶液中通入H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是_______________mol·L-1。
(1)硼酸(H3BO3)溶液中存在如下反应:
H3BO3(aq)+H2O(l) [B(OH)4]-(aq)+H+(aq)。已知25℃时它的电离常数K=5.7×10-10。则此温度下0.7 mol·L-1硼酸溶液中H+的浓度= 。(计算结果保留小数点后一位)
[B(OH)4]-(aq)+H+(aq)。已知25℃时它的电离常数K=5.7×10-10。则此温度下0.7 mol·L-1硼酸溶液中H+的浓度= 。(计算结果保留小数点后一位)
(2)常温下,0.1 mol·L-1的氯化铵溶液pH=5.1.若常温下氨水的电离常数Kb=10-X,则x= 。