将一定量的氯气通入30 mL浓度为10.00 mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是
| A.与NaOH反应的氯气一定为0.15 mol |
| B.n(Na+)∶n(Cl-) 可能为7∶3 |
| C.若反应中转移的电子为n mol,则0.15 < n < 0.25 |
| D.n(NaCl)∶n(NaClO)∶n(NaClO3)可能为11∶2∶1 |
在一个密闭容器中发生如下反应:2SO2(g)+O2(g) 2SO3(g),反应过程中某一时刻测得SO2、O2、SO3的浓度分别为:0.2 mol·L—1,0.2 mol·L—1,0.2 mol·L—1,当反应达到平衡时,可能出现的数据是
2SO3(g),反应过程中某一时刻测得SO2、O2、SO3的浓度分别为:0.2 mol·L—1,0.2 mol·L—1,0.2 mol·L—1,当反应达到平衡时,可能出现的数据是
| A.c(SO3)="0.4" mol·L—1 |
| B.c(SO2)=c(SO3)="0.15" mol·L—1 |
| C.c(SO2)="0.25" mol·L—1 |
| D.c(SO2)+c(SO3)="0.4" mol·L—1 |
已知298K时反应2SO2( g ) + O2( g )  2SO3( g );△H =" -197" kJ · mol-1,在相同温度下向一密闭容器中加入2 mol SO2和1 molO2,达化学平衡时放出热量为a1 kJ ;向另一容积相同的密闭容器中通入 1 mol SO2和0.5 molO2,达化学平衡时放出热量为a2 kJ ,则下列关系式中正确的是()
2SO3( g );△H =" -197" kJ · mol-1,在相同温度下向一密闭容器中加入2 mol SO2和1 molO2,达化学平衡时放出热量为a1 kJ ;向另一容积相同的密闭容器中通入 1 mol SO2和0.5 molO2,达化学平衡时放出热量为a2 kJ ,则下列关系式中正确的是()
| A.2a2<a1< 197 |
| B.2a2>a1 >197 |
| C.2a2 = a1 >197 |
| D.2a2 = a1 = 197 |
以下是几位同学在学习了化学反应速率和化学平衡理论以后发表的一些看法,其中不正确的是
| A.化学反应速率理论可指导怎样在一定时间内快出产品 |
| B.化学平衡理论可指导怎样使用有限原料多出产品 |
| C.化学反应速率理论可指导怎样提高原料的转化率 |
| D.正确利用化学反应速率和化学平衡理论可提高化工生产的综合经济效益 |
向2L密闭容器里充人2mol M和一定量的N,发生如下反应:
M(g)+N(g)  E(g)当反应进行到4min时,测知M的浓度为0.2mol/L;反应进行到2min时,密闭容器中M的物质的量浓度为()
E(g)当反应进行到4min时,测知M的浓度为0.2mol/L;反应进行到2min时,密闭容器中M的物质的量浓度为()
| A.等于0.6mol/L |
| B.小于0.6mol/L |
| C.等于0.8mol/L |
| D.大于0.8mol/L |
一带有活塞的密封容器中盛有A、B组成的混合气体,在通常条件下,从状态I反应到状态II时,气体体积(V)与气体压强(P)的变化曲线如图所示。 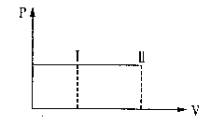
则反应:A(g)+B(g)="2C(g)"
A.是放热反应 B.反应后气体总分子数增多
C.是吸热反应 D.反应物具有的总能量等于生成物具有的总能量