(本题共12分)乙醚极易挥发、微溶于水、是良好的有机溶剂。乙醇与浓硫酸的混合物在不同温度下反应能生成乙烯或乙醚。某实验小组用下图装置制取乙醚和乙烯。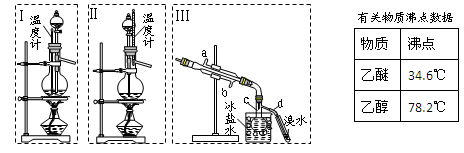
1.制乙醚:在蒸馏烧瓶中先加入10 mL乙醇,慢慢加入10 mL浓硫酸,冷却,固定装置。加热到140℃时,打开分液漏斗活塞,继续滴加10 mL乙醇,并保持140℃,此时烧瓶c中收集到无色液体。
(1)Ⅰ和Ⅱ是反应发生装置,应该选择______(选答“Ⅰ”或“Ⅱ”)与装置Ⅲ相连。
(2)乙醇通过分液漏斗下端连接的长导管插入到液面下加入,目的有二,一是使反应物充分混合,二是_________________。
2.Ⅲ中水冷凝管的进水口是______(选答“a”或“b”)。冰盐水的作用是___________。
3.有同学认为以上装置还不够完善,一是溴水可能倒吸,二是尾气弥漫在空气中遇明火危险。该同学设计了以下几种装置与导管d连接,你认为合理的是(选填编号)_______。
4.反应一段时间后,升温到170℃,观察到反应物变为黑色,溴水褪色。写出实验过程中所有生成气体的反应方程式____________________________。
5.实验中收集到的乙醚产品中可能含有多种杂质。某同学设计了以下提纯方案:
(1)分液步骤除去产品中的酸性杂质,则X可以是________________。
(2)蒸馏操作可除去的杂质是____________。
6.工业乙醚常因接触空气和光而被氧化,含有少量过氧化物,除去过氧化物的试剂及操作分别是(选填编号)______________。
a.CCl4、萃取 b.Na2SO3溶液、分液
c.Na2SO4溶液、过滤 d.酸化的FeSO4溶液、分液
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式 有;
有;
(2)硫酸铜溶液可以加快氢气生成速率的原因是
;
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中
CuSO4溶液起相似作用的是 ;
(4)要加快上述实验中气体产生的速率,还可采取的措施有
;
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体。
记录获得相同体积的气体所需时间。
 实验 实验混合溶液 |
A |
B |
C |
D |
E |
F |
| 4 mol·L-1 H2SO4/mL |
30 |
V1 |
V2 |
V3 |
V4 |
V5 |
| 饱和CuSO4溶液/mL |
0 |
0.5 |
2.5 |
5 |
V6 |
20 |
| H2O/mL |
V7 |
V8 |
V9 |
V10 |
10 |
0 |
①请完成此实验设计,其中:V1=,V6=,V9=;
②反应一段时间后,实验A的金属是呈色,实验E中的金属呈;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因。 .
已知A为一无机盐,C、D、F、N、O为无色气体,E常温常压下为无色无味的液体,N、H、L为高中常见的单质,I为常见无氧强酸,M的焰色反应为紫色,反
应①常用于气体F的检验。
(1)写出G的电子式_______________,M的化学式_____________;
(2)写出反应②的离子反应方程式______________________________;
(3)写出反应③的化学反应方程式_____________;反应①—④中属于非氧化还原反应的是;
(4)用石墨电极电解溶液K时,电解初始阶段电极反应方程式为:
阴极___________________阳极___________________;
(5)已知A在隔绝空气条件下分解产生的各产物的物质的量之比为
B:C:D:E:F=1:2:2:2:2,写出A分解的反应方程式______________。
(10分)葡萄糖是人类的营养素,在体内富氧条件下被氧化生成二氧化碳和水,在缺氧条件下则生成一种有机酸A。将A进行如下图所示的反应。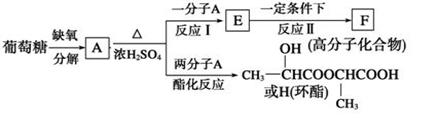
回答下列问题:
(1)写出结构简式:F____________,H________________。
(2)写出下列转化的化学方程式:
E―→F____________________________________________________;
A―→H____________________________________________________。
含有氨基(—NH2)的化合物通常能够与盐酸反应,生成盐酸盐。如:R—NH2+HCl―→R—NH2·HCl(—R代表烷基、苯基等);现有两种化合物A和B,它们互为同分异构体。已知:
①它们都是对位二取代苯;
②它们的相对分子质量都是137;
③A既能被NaOH溶液中和,又可以跟盐酸成盐,但不能与FeCl3溶液发生显色反应;B既不能被NaOH溶液中和,也不能跟盐酸成盐;
④它们的组成元素只能是C、H、O、N、Cl中的几种。
请按要求填空:
(1)A和B的分子式是__________。
(2)A的结构简式是________;B的结构简式是______。
有A、B、C、D四种元素。其中A为第四周期元素,与D可行成1∶1和1∶2原子比的化合物。B为第四周期d区元素,最高化合价为7。C和B是同周期的元素,具有相同的最高化合价。D为所有元素中电负性第二大的元素 。
。
(1)试写出四种元素的元素符号:A____ B____ C____ D____
(2)按电负性由大到小排列:________________。