随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2 的含量及有效地开发利用CO2 ,引起了各国的普遍重视。

(1)目前工业上有一种方法是用CO2 来生产燃料甲醇。为探究反应原理,现进行如下实验,
在体积为1 L的密闭容器中,充入1mol CO2 和3mol H2 ,一定条件下发生反应:
CO2 (g)+3H2 (g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol
测得CO2 和CH3OH(g)的浓度随时间变化如图所示。
①从反应开始到平衡,氢气的平均反应速率 v (H2 )=___________mol/(L·min)。
②该反应的平衡常数表达式为__________________。
③下列措施中能使 n(CH3OH)/n(CO2)增大的是___________。
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离 | D.再充入1molCO2 和3molH2 |
(2)①在载人航天器的生态系统中,不仅要求分离去除CO2 ,还要求提供充足的O2 。某种电化学装置可实现如下转化:2CO2 =2CO+O2 ,CO可用作燃料。
已知该反应的阳极反应为:4OH— —4e— =O2↑+2H2O
则阴极反应式为:____________________________。
②有人提出,可以设计反应2CO=2C+O2 (△ H >0、△S<0)来消除CO的污染。请你判断是否可行并说出理由:_________;____________________________________。
本题16分,①下列两幅谱图是结构简式为CH3CH2CH2OH和CH3CH(OH)CH3的两种有机化合物的1H核磁共振谱图。请判断哪一幅是CH3CH(OH)CH3的1H—NMR谱图,并说明理由。
②、0.2 mol有机物和0.4 mol O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g)。燃烧后的这些产物经过浓H2SO4后,质量增加10.8 g;再通过灼热的CuO充分反应后,固体质量减轻3.2 g,最后气体再通过碱石灰被完全吸收,质量增加17.6 g。(可能用到的相对原子质量H-1,C-12,O-16,Cu-64)
(1)推断该有机物的分子式。
(2)若0.2 mol该有机物在与过量的金属钠完全反应后放出4.48 L H2(标准状况),试确定有机物的结构简式。
本题共有2小题,共15分,①命名下列有机物
②有人曾提出苯除了有平面正六边形结构外,还可能有空间立体结构,例如下面的Ⅰ式和Ⅱ式:
Ⅰ式: Ⅱ式:
Ⅱ式:
(1)若以Ⅰ式为主体,其一元取代物分子中2,4,6位上的氢原子性质相同,3,5位上的氢原子性质相同。则2,4,6-三氯硝基苯的结构简式为_____________。
(2)若Ⅱ式分子生成二氯苯,其可能有的同分异构体有6种,则其四氯苯的同分异构体有_______种。
根据下面的反应路线及所给信息填空。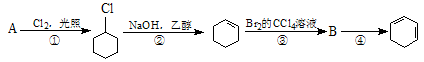
(1)A的结构简式是,名称是。
(2)①的反应类型是;②的反应类型是。
(3)反应④的化学方程式是。
质子核磁共振谱(PMR)是研究有机物结构的重要方法之一。在研究的化合物分子中:所处环境完全相同的氢原子在PMR谱中出现同一种信号峰:如(CH3)2CHCH2CH3在PMR谱中有四种信号峰。又如CH3-CHBr=CHX存在着如下的两种不同空间结构: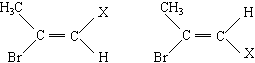
因此CH3-CHBr=CHX的PMR谱上会出现氢原子的四种不同信号峰。
请填写下列空白:
(1)化学式为C3H6O2的物质在PMR谱上观察到下列两种情况下氢原子给出的信号峰:第一种情况出现两个信号峰,第二种情况出现三个信号峰,由此可推断对应于这两种情况该有机物质结构式可能为:;;
(2)测定CH3CH=CHCl时:能得到氢原子给出的信号峰6种:由此可推断该有机物一定存在种不同的结构:其结构式为:。
写出下列物质的结构简式(每小题3分,共6分):
(1)2,2-二甲基-3-乙基己烷(2)2-甲基-2-丁烯
_______________________________、_____________________________