材料1:铁及其化合物在工农业、生活中有广泛的应用。高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。
(1)已知:4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2。
4Fe(OH)3+8OH-+3O2。
K2FeO4在处理水的过程中所起的作用有 。
(2)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-) =1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ。该实验的目的是 ;发生反应的△H 0(填“>”、“<”或“=”)。
(3)FeO42-在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是 (填字母)。
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:
HFeO4-+OH-=FeO42-+H2O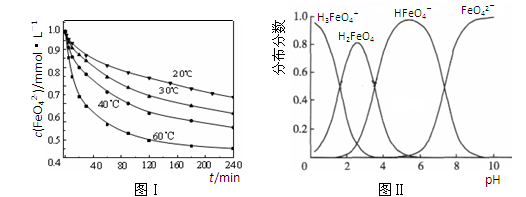
材料2:化合物KxFe(C2O4) y·zH2O(Fe为+3价)是一种光敏感材料,实验室可以用如下方法制备这种材料并测定其组成。
I.制备:
(4)结晶时应将饱和溶液在黑暗处等待晶体的析出,这样操作的原因是 。
(5)操作Ⅲ的名称是 。
Ⅱ.组成测定:
称取0.491g实验所得晶体(假设是纯净物)置于锥形瓶中,加足量蒸馏水和稀H2SO4。将C2O42-完全转化为H2C2O4,用0.10mol·L-1KMnO4溶液进行滴定,消耗KMnO4溶液12.00mL时恰好反应;再加入适量的还原剂,将Fe3+完全转化为Fe2+,用KMnO4溶液继续滴定,当Fe2+完全氧化时,用去KMnO4溶液2.00mL。相关反应如下:
2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
(6)配制250mL 0.10mol·L-1KMnO4溶液及上述滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶外还有 和 。两个滴定中到达终点时溶液颜色为 色,且30秒内不变色。
(7)通过计算,求此光敏材料的化学式 。
小康同学用一定量的Na2O2与水反应,制取中学一种常见气体。
(1)相关反应的化学方程式是__________________________________,检验反应生成气体的方法是。
(2)利用本实验所得到的溶液(经检测为400 mL 1.0 mol/ L的碱溶液),小康又进行了两个自己感兴趣的实验。
①取100 mL 该溶液用于氯气的尾气吸收,则最多可吸收标准状况下的氯气多少升?(请写出相关反应的方程式或关系式,并列式计算,下同)
②取100 mL 该溶液恰好能与10 g某镁铝合金恰好完全反应,请计算该合金中铝的质量分数。
下列框图所示的转化关系中,A、B、C、D、E都是常见元素的单质,在常温常压下A是固体,其余都是气体,且C呈黄绿色。化合物H和I两种气体相遇时产生白烟。化合物G的焰色反应为黄色。通常情况下L是无色液体。反应①和②均在溶液中进行。
请按要求问答下列问题:
(1)写出下列物质的化学式:F、K。
(2)若反应①在溶液中进行,其离子方程式为。
(3)实验室制取I的化学方程式为。
(4)向J溶液中滴入NaOH溶液时,现象为,用化学方程式解释该变化过程。
除去下表内各物质中含有的少量杂质,写出除杂试剂,并填写分离方法或反应的离子方程式。
| 序号 |
物质 |
杂质 |
所加试剂 |
分离方法 |
离子方程式 |
| (1) |
FeCl3溶液 |
FeCl2 |
(不需填写) |
||
| (2) |
Fe粉 |
Al粉 |
|||
| (3) |
NaHCO3溶液 |
Na2CO3 |
(不需填写) |
A、B、C三种物质都是H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈中性,B的水溶液呈碱性,C的水溶液呈酸性,请找出B、C可能的两种组合,要求B1溶液中水的电离程度小于B2溶液中水的电离程度,C1溶液中水的电离程度小于C2溶液中水的电离程度。(已知0.1mol/LHNO2溶液pH>1)
(1)写出化学式: A____________ B1____________ B2____________
(2)25℃时,B1溶液中水电离出的OH—的物质的量浓度_______10—7mol/L
(填>、<、=)
(3)25℃时,当B1、C1两稀溶液的物质的量浓度相等时,两溶液的pH值之和_____14(填>、<、=、≥、≤)。
(4)25℃时,pH=a(3<a<5)的C1、C2两溶液中水电离出的H+的物质的量浓度比值为。(用含a的代数式表示)
1932年美国化学家鲍林首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:
| 元素 |
H |
Li |
Be |
B |
C |
N |
O |
F |
| 电负性 |
2.1 |
1.0 |
1.5 |
2.0 |
2.5 |
3.0 |
3.5 |
4.0 |
| 元素 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
K |
| 电负性 |
0.9 |
1.2 |
1.5 |
1.7 |
2.1 |
2.3 |
3.0 |
0.8 |
请仔细分析,回答下列有关问题:
① 预测周期表中电负性最大的元素应为____________;估计钙元素的电负性的取值范围:0.8< X <___________。
②写出K的基态原子的电子排布式:
K:_______________________________________
③根据表中的所给数据分析,同主族内的不同元素X的值变化的规律
是;简述元素电负性X的大小与元素金属性、非金属性之间的关系____________________。