钠的化合物在生产和生活中起到重要的作用。请回答下列问题:
(1)碳酸氢钠俗称 ,水溶液呈 性。碳酸氢钠粉末可用于治疗胃酸(0.2%-0.4%的盐酸)过多,反应的离子方程式是 ;
(2)除去NaHCO3溶液中少量的Na2CO3溶液, (填“能”或“不能”)用足量的澄清石灰水,原因是_______________用离子方程式表示);等质量的碳酸钠和碳酸氢钠分别与足量稀盐酸反应产生气体的物质的量之比 ;
(3)过氧化钠可用于呼吸面具或潜水艇中氧气的来源,写出化学反应方程式,并用双线桥法标电子转移的方向和数目 ;若有5. 6L水蒸气通过一 定质量的过氧化钠粉末后,气体体积减小到4.48 L,则气体的成分是 ,气体的总质量是 。(气体体积已折算成标准状况)
【化学—选修3物质结构与性质】(1)A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
| 电离能(KJ/mol) |
I1 |
I2 |
I3 |
I4 |
| A |
932 |
1821 |
15390 |
21771 |
| B |
738 |
1451 |
7733 |
10540 |
根据上述信息,写出B的基态原子核外电子排布式,预测A和氯元素形成的简单分子空间构型为。
(2)钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,往其中一种配合物的溶液中加入AgNO3溶液时,无明显现象,往其溶液中加BaCl2溶液时若,产生白色沉淀,则该配合物的化学式为,中心离子的配位数为。
(3)参考下表中的物质熔点回答下列问题
| 物质 |
NaF |
NaCl |
NaBr |
NaI |
NaCl |
KCl |
RbCl |
CsCl |
| 熔点(℃) |
995 |
801 |
755 |
651 |
801 |
776 |
715 |
646 |
根据上表数据解释钠的卤化物及碱金属的氯化物的熔点变化规律。
(4)C60可用作储氢材料。C60的结构如图1。已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确,并阐述理由。科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体,该物质的K原子和C60分子的个数比为。
(5)三聚氰胺分子的结构简式如图3,则其中氮原子轨道杂化类型是,l mol三聚氰胺分子中含mol 键。
键。
(6)碳化硅的晶胞与金刚石的晶胞相似如图4,设晶胞边长为a cm,碳原子直径为b cm,硅原子直径为c cm,则该晶胞的空间利用率为(用含a、b、c的式子表示)。
【化学——选修2:化学与技术】(15分)利用生产磷铵[(NH4)3PO4]排放的废渣磷灰石[(Ca3(PO4)2)]制取硫酸并联产水泥的工艺流程如下:
(1)操作a的名称,实验室中进行此操作时用到的玻璃仪器有。
(2)在实验室中操作b包括____、冷却结晶。
(3)干燥机中发生反应的化学方程式为。
(4)水泥常用做建筑材料,是利用了水泥的性质。
(5)SO2的催化氧化反应为2SO2(g)十O2(g) 2SO3(g)。实验测得压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为SO2:7%、02:11%、N2:82%)。
2SO3(g)。实验测得压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为SO2:7%、02:11%、N2:82%)。
①实际生产中,SO2的催化氧化反应是在常压、400℃—500℃条件下进行。采用常压的主要原因是;该反应化学平衡常数大小关系是:K(400℃)K(500℃)(填“>”、“<”或“=”)。
②催化氧化时使用热交换器的原因是。
(6)制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。下列能用于测定硫酸尾气中SO2含量的试剂组是。(填写相应字母)
a、NaOH溶液、酚酞试液b、Na2CO3溶液、酚酞试液
c、碘水、淀粉溶液d、KMnO4溶液、稀硫酸
(14分)锂及锂盐具有的优异性能和特殊功能,在化工、电子、宇航、核能、能源等领域都得到广泛应用;锂元素更是被誉为“能源元素”。
Ⅰ 锂的原子结构示意图为;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色。生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂。写出生成氮化锂的化学方程式。锂在空气中燃烧,发出浅蓝色的火焰,放出浓厚的白烟,生成相应氧化物 _____(填化学式)。
Ⅱ 下面是从锂辉石(Li2O·Al2O3·SiO2)中提出锂的工业流程示意图。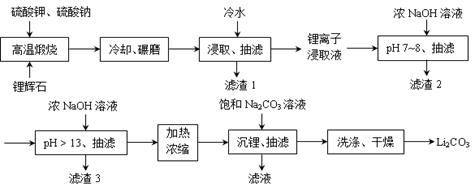
① 高温煅烧时的反应原理为:Li2O∙Al2O3∙SiO2+K2SO4= K2O∙Al2O3∙SiO2+Li2SO4;
Li2O∙Al2O3∙SiO2+Na2SO4= Na2O∙Al2O3∙SiO2+Li2SO4。
②锂离子浸取液中含有的金属离子为:K+、Na+、Li+、Fe3+、Fe2+、Al3+、Mn2+ 。
③几种金属离子沉淀完全的pH
| 金属离子 |
Al(OH)3 |
Fe(OH)2 |
Fe(OH)3 |
Mn(OH)2 |
| 沉淀完全的pH |
4.7 |
9.0 |
3.2 |
10.1 |
④Li2SO4、Li2CO3在不同温度下的溶解度(g / 100g水)
| 温度 溶解度 |
10 |
20 |
50 |
80 |
| Li2SO4 |
35.4 |
34.7 |
33.1 |
31.7 |
| Li2CO3 |
1.43 |
1.33 |
1.08 |
0.85 |
(1)浸取时使用冷水的原因是。
(2)滤渣2的主要成分为。
(3)流程中分2次调节pH(pH7~8和pH > 13),有研究者尝试只加一次浓NaOH溶液使pH> 13,结果发现在加饱和碳酸钠溶液沉锂后,随着放置时间延长,白色沉淀增加,最后得到的Li2CO3产品中杂质增多。Li2CO3产品中的杂质可能是,用离子方程式表示其产生的原因。
(4)加热浓缩的作用是。
(5)洗涤Li2CO3晶体使用。
(14分)CO2和H2可用于合成甲醇和甲醚。
(1)已知①CH3OH(l)+ O2(g) ="=" CO2(g)+2H2O(l) ΔH=-725.5 kJ·mol-1
O2(g) ="=" CO2(g)+2H2O(l) ΔH=-725.5 kJ·mol-1
②H2(g)+ O2(g) ="=" H2O(g)ΔH =-241.8 kJ·mol-1
O2(g) ="=" H2O(g)ΔH =-241.8 kJ·mol-1
③H2O(g) ="=" H2O(l) ΔH =-44 kJ·mol-1
则工业上以CO2(g)、H2(g)为原料合成CH3OH(l),同时生成H2O(l)的热化学方程式为_______。
(2)将CO2转化为甲醚的反应原理为2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(l)
CH3OCH3(g)+3H2O(l)
已知在投料比n(CO2):n(H2)=1:3的条件下,不同温度、不同压强时,CO2的转化率见下表:
①下列关于上述可逆反应的说法正确的是
| A.在恒温、恒容的密闭容器中,当反应混合气体的密度保持不变时反应达平衡状态 |
| B.当v正(CO2)=" 3" v逆(H2),反应达平衡状态 |
| C.当n(CO2):n(H2)=1:3时,反应达平衡状态 |
| D.a > 60% |
②上述反应的化学平衡常数的表达式为__________。
③该反应的ΔH 0,原因是。
④在压强为P、温度为500K、投料比n(CO2):n(H2)=1:3的条件下,反应达平衡状态时H2的转化率为,混合气体中CO2的体积分数为。
(3)以甲醇、空气、KOH溶液为原料可设计成燃料电池:放电时,负极的电极反应式为。
一氧化碳是一种用途广泛的化工基础原料。
(l)在高温下CO可将SO2还原为单质硫。
已知:①2CO(g)+O2(g)=2CO2(g)ΔH=-566.0kJ/mol
②S(s)+ O2(g)=SO2(g)ΔH=-296.0kJ/mol
请写出CO还原SO2的热化学方程式______。
(2)工业土用一氧化碳制取氢气的反应为:CO(g)+H2O(g)  CO2(g) +H2(g)。已知420℃时,该反应的化学平衡常数K=9。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为_________,H2的平均生成速率为mol·L-1min-1,其他条件不变时,升温至520℃,CO的转化率增大,该反应为___________反应(填“吸热”或“放热”);
CO2(g) +H2(g)。已知420℃时,该反应的化学平衡常数K=9。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为_________,H2的平均生成速率为mol·L-1min-1,其他条件不变时,升温至520℃,CO的转化率增大,该反应为___________反应(填“吸热”或“放热”);
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图
电池总反应为:2CH3OH+3O2=2CO2+4H2O,则c电极是(填“正极”或“负极”),c电极的反应方程式为。若用该电池电解精炼铜(杂质含有Ag和Fe),粗铜应该接此电源的___________极(填“c”或“d”),反应过程中析出精铜64g,则上述CH3OH燃料电池,消耗的O2在标况下的体积为L。