反应3Fe(S)+4H2O(g)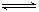 Fe3O4(s)+4H2(g),在一可变的容积的密闭容器中进行,试回答:
Fe3O4(s)+4H2(g),在一可变的容积的密闭容器中进行,试回答:
①增加Fe的量,其正反应速率的变化是 (填增大、不变、减小,以下相同)全部移走Fe3O4,其正反应速率的变化是 ②将容器的体积缩小一半,其正反应速率 其逆反应速率 ③保持体积不变,充入N2使体系压强增大,其正反应速率 其逆反应速率 ④保持压强不变,充入N2使容器的体积增大,其正反应速率 其逆反应速率
某有机物的结构简式为HOOC—CH=CHCH2OH
(1)该有机物在一点条件下既能发生加聚反应又能发生缩聚反应,请分别写出产物的结构简式_______________;。
(2)验证该有机物中含有—COOH常采用的试剂是,产生的现象为。
(3)请从下列试剂中选择适当试剂,检验该有机物分子中含有醇羟基,并写出实验方法和现象
备选试剂:①钠②NaOH溶液③溴水④酸性KMnO4溶液⑤新制Cu(OH)2悬浊液
已知乙烯能发生以下转化: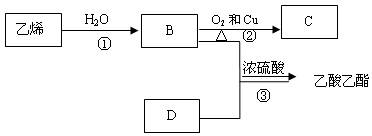
(1)工业制取乙烯的原料为
(2)写出B、D化合物中官能团:B中含官能团;D中含官能团;
(3)写出反应的化学方程式及反应类型
①反应类型
② 反应类型
③反应类型
(4)若工业上用空气代替氧气进行反应②,主要优点是_______,缺点是____。
(1)相对分子质量为72的某烃,其一氯代物只有一种,则该烃的一氯代物的结构简式为______________________。
(2)某有机物含有C、H、O、N等四种元素,如上图为该有机物的球棍模型。该有机物的分子式为。结构简式为。
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有;
(2)硫酸铜溶液可以加快氢气生成速率的原因是;
(3)实验室中现有 、
、 、
、 、
、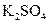 等4中溶液,可与实验中
等4中溶液,可与实验中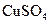 溶液起相似作用的是;
溶液起相似作用的是;
(4)要加快上述实验中气体产生的速率,还可采取的措施有(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实验 混合溶液 |
A |
B |
C |
D |
E |
F |
| 4mol/LH2SO4/mL |
30 |
V1 |
V2 |
V3 |
V4 |
V5 |
| 饱和CuSO4溶液/mL |
0 {007} |
0.5 |
2.5 |
5 |
V6 |
20 |
| H2O/mL |
V7 |
V8 |
V9 |
V10 |
10 |
0 |
①请完成此实验设计,其中:V1=,V6=,V9=;
②该同学最后得出的结论为:当加入少量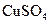 溶液时,生成氢气的速率会大大提高。但当加入的
溶液时,生成氢气的速率会大大提高。但当加入的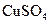 溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因。
溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因。
苯是一种重要的化工原料,也是一种重要的溶剂。请回答下列问题:
⑴把苯加入到盛有溴水的试管中,液体会出现分层现象,充分振荡、静置,出现橙红色液体的一层在层(填“上”或“下”);
⑵把苯加入到盛有少量高锰酸钾溶液的试管中,振荡后,酸性高锰酸钾溶液不褪色,说明苯分子中(填“有”或“没有”)碳碳双键;
⑶在浓硫酸作用下,苯在50~60℃可以与浓硝酸反应生成硝基苯,反应的化学方程式为。