下图是锌片和铜片在稀硫酸中所组成的原电池装置,c、d为两个电极。下列有关的判断不正确的是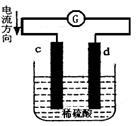
| A.电池工作的过程中,d电极上产生气泡 |
| B.电池工作时,溶液中SO42-向d移动 |
| C.c为负极,发生氧化反应 |
| D.电池工作的过程中,溶液中SO42-浓度基本不变 |
反应2SO2+O2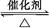 2SO3经一段时间后,SO3的浓度增加了0.4 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·(L·s)-1,则这段时间为( )
2SO3经一段时间后,SO3的浓度增加了0.4 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·(L·s)-1,则这段时间为( )
| A.0.1 s | B.2.5 s | C.10 s | D.5 s |
某温度时,浓度都是1 mol·L-1的两种气体X2和Y2,在密闭容器中发生可逆反应生成气体Z,充分反应后X2的浓度为0.4 mol·L-1,Y2的浓度为0.8 mol·L-1,生成的Z的浓度为0.4 mol·L-1,则该反应的化学方程式(Z用X、Y表示)是( )
A.X2+2Y2 2XY2 2XY2 |
B.2X2+Y2 2X2Y 2X2Y |
C.X2+3Y2 2XY3 2XY3 |
D.3X2+Y2 2X3Y 2X3Y |
反应4A(s)+3B(g) 2C(g)+D(g),经2 min B的浓度减少0.6 mol·L-1。对此反应速率的正确表示是( )
2C(g)+D(g),经2 min B的浓度减少0.6 mol·L-1。对此反应速率的正确表示是( )
A.用A表示的反应速率是0.8 mol·L-1·s-1
B.分别用B、C、D表示反应的速率,其比值是3∶2∶1
C.在2 min末时的反应速率,用反应物B来表示是0.3 mol·L-1·min-1
D.在这2 min内用B和C表示的反应速率的值都是相同的
已知反应:A+3B 2C+D,在某一段时间内以A的浓度变化表示的化学反应速率为1 mol·L-1·min-1,则此段时间内以C的浓度变化表示的化学反应速率为( )
2C+D,在某一段时间内以A的浓度变化表示的化学反应速率为1 mol·L-1·min-1,则此段时间内以C的浓度变化表示的化学反应速率为( )
| A.0.5 mol·L-1·min-1 | B.1 mol·L-1·min-1 |
| C.2 mol·L-1·min-1 | D.3 mol·L-1·min-1 |
某一反应物的浓度是2.0 mol·L-1,经过4 min后,它的浓度变成1.68 mol·L-1,则在这4 min内它的平均反应速率为( )
| A.0.2 mol·L-1·min-1 | B.0.1 mol·L-1·min-1 |
| C.0.04 mol·L-1·min-1 | D.0.08 mol·L-1·min-1 |