键能是指破坏(或形成)1mol化学键所吸收(或放出)的能量。现查得:H-H、Cl-Cl和H-Cl的键能分别为436KJ/mol、243KJ/mol和431KJ/mol,请用此数据估计,由Cl2、H2生成1molHCl时的热效应为
| A.放热91.5KJ | B.放热183KJ | C.吸热183KJ | D.吸热91.5KJ |
下列说法正确的是()
| A.氢键有方向性和饱和性,属于共价键 |
| B.分子形成氢键一定使物质的熔沸点升高 |
| C.甲醇(CH3OH)比甲硫醇(CH3SH)熔点高,原因是甲醇分子间易形成氢键 |
| D.H2O是一种非常稳定的化合物,这是由于氢键所致 |
下列关于杂化轨道的叙述中,不正确的是()
| A.分子中中心原子通过SP3杂化轨道成键时,该分子不一定为正四面体结构 |
| B.杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对 |
| C.乙酸分子中三种原子均以杂化轨道成键 |
| D.N2分子中N原子没有杂化,分子中有一个σ键、2个π键 |
下列分子中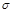 键与
键与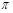 键数之比为3∶1的是()
键数之比为3∶1的是()
| A.N2 | B.C2H4 | C.HCHO | D.HCN |
下列叙述正确的是( )
| A.化合物中一定含有σ键,可能含π键 |
| B.由非金属元素组成的化合物不一定是共价化合物 |
| C.非极性键只存在于单质分子里 |
| D.所有原子轨道在空间都具有自己的方向性 |
现有5种短周期元素X、Y、Z、Q、W,原子序数依次增大,在周期表中X原子半径最小;X和W同主族;Y元素原子核外电子总数是其次外层电子数的3倍;Q元素是地壳中含量最高的元素。下列说法不正确的是()
| A.ZX3可使紫色石蕊溶液变蓝 |
| B.X、Z、Q 3种元素可组成离子化合物或共价化合物 |
| C.离子半径:Z<Q<W |
| D.X2Q2、Y2X62种分子中含有的电子数、化学键种类都相同 |