芳香族化合物A有如下的转化关系:
已知C的结构简式为 ,F能使溴的CCl4溶液褪色。请回答下列问题:
,F能使溴的CCl4溶液褪色。请回答下列问题:
(1)C→E的反应类型是________________。
(2)写出结构简式:A ;G 。
(3)请写出E→F反应的化学方程式: 。
(4)检验B中一种官能团的实验操作是 。
(5)若有机物H与D互为同分异构体,则与有机物B互为同系物的H的同分异构体有
种,任写一种符合此条件的H的结构简式 。
(Ⅰ)某温度下,NaCl溶液中的c(H+)=2.0×10-7 mol/L,则此时在溶液中:
(1)由水电离产生的c(OH-)= ;
(2)若温度不变,滴入稀硫酸使c(H+)=5.0×10-6 mol/L,则c(OH-)= 。
(Ⅱ)(3)某温度下水的离子积为KW =1×10-13,则该温度(填“大于”、“等于”或“小于”)
25℃。
若将此温度下pH=11的NaOH溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),试通过填写以下不同情况时两种溶液的体积比:
(4)若所得混合液为中性,则a∶b= ;
(5)若所得混合液的pH=2,则a∶b= ;
(6)某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,若测定结果偏高,其原因可能是 。
| A.配制标准溶液的固体NaOH中混有KOH杂质 |
| B.滴定终点读数时,仰视滴定管的刻度,其他操作正确 |
| C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗 |
| D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液 |
(1)将标况下的2.24LCO2通入150mL 1mol•L-1NaOH溶液中,溶液中离子浓度由大到小的顺序为
(2)0.02mol/L的醋酸溶液与0.01mol/L的氢氧化钠溶液等体积混合,混合后溶液的pH=6,则溶液中除水分子外粒子浓度(含CH3COOH)由大到小的顺序为 ,溶液中c(CH3COO—)-c(Na+)= (写出精确计算结果)
已知25℃时Ksp[Mg(OH)2]=1.0×10-11,Ksp[Cu(OH)2]=2.2×10-20。
(3)在25 ℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式)。
(4)室温时,Mg(OH)2(S) Mg2+(aq)+2OH-(aq) 当Mg2+沉淀完全(离子浓度小于10-5mol/L)时,溶液的pH=_______。
Mg2+(aq)+2OH-(aq) 当Mg2+沉淀完全(离子浓度小于10-5mol/L)时,溶液的pH=_______。
(1)由于SiH4具有易提纯的特点,因此硅烷热分解法是制备高纯硅很有发展潜力的方法。制备硅烷整个过程必须严格控制无水,否则生成的硅烷将发生变质,其化学方程式为 ,整个系统还必须与氧隔绝,其原因是 (用化学方程式表示)
(2)无机非金属材料是日常生活中不可缺少的物质,它们往往具有高强度、耐高温、耐腐蚀的特点。Si3N4就是一种重要的精细陶瓷,合成氮化硅的方法之一为: ,Si3N4属于原子晶体,在上述反应中氧化剂为
,Si3N4属于原子晶体,在上述反应中氧化剂为
(3)硅酸盐中,SiO44-四面体通过共用顶角氧离子可形成链状、层状、空间网状等结构型式。下图为一种无限长双链结构的多硅酸根,其中Si原子的杂化形式为 ,该多硅酸根化学式为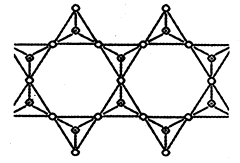
苯乙烯是重要的基础有机原料。工业中用乙苯(C6 H5- CH2 CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6 H5- CH= CH2)的反应方程式为:
(1)向体积为VL的密闭容器中充入a mol乙苯,反应达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示:
由图可知:在600℃时,平衡体系中苯乙烯的物质的量分数为25%,则:
①氢气的物质的量分数为 ;
②乙苯的平衡转化率为 ;
③计算此温度下该反应的平衡常数 。
(2)已知某温度下,当压强为101.3kPa时,该反应中乙苯的平衡转化率为30%;在相同温度下,若反应体系中加入稀释剂水蒸气并保持体系总压为101.3kPa,则乙苯的平衡转化率 30%(填“>、=、<” )。
(3)已知: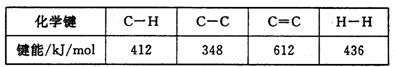
计算上述反应的ΔH= kJ/mol。
(1)某小组分析二氧化铅分解产物的组成,取478g的PbO2加热,PbO2在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的a为96.66%,则a点固体的分子式为
已知PbO2与硝酸不反应且氧化性强于硝酸,而PbO是碱性氧化物,能和酸反应,写出上述分解产物与硝酸反应的化学方程式
(2)①另一实验小组也取一定量的PbO2加热得到了一些固体,为探究该固体的组成,取一定质量该固体加入到30 mLCH3COOH一CH3COONa溶液中,再加入足量KI固体,摇荡锥瓶使固体中的PbO2与KI全部反应而溶解,得到棕色溶液。写出PbO2参与该反应的化学方程式 ,用淀粉指示剂,0.2 mol/L的Na2S2O3标准溶液滴定至溶液蓝色刚消失为止, ,Na2S2O3标准溶液的消耗量为20 mL。
,Na2S2O3标准溶液的消耗量为20 mL。
②固体加入到醋酸而非盐酸中是因为会产生有毒气体,写出反应的化学方程式
用CH3COOH一CH3COONa的混合液而不用CH3COOH可以控制pH不至于过低,否则会产生浑浊和气体,请写出该反应的化学方程式
③取相同质量的上述固体与硝酸混合,过滤出的滤液加入足量的铬酸钾溶液得到铬酸铅(PbCrO2相对分子质量323)沉淀,然后 ,得固体质量为0.969g,依据上述数据,该固体的分子式 。