(1)由于SiH4具有易提纯的特点,因此硅烷热分解法是制备高纯硅很有发展潜力的方法。制备硅烷整个过程必须严格控制无水,否则生成的硅烷将发生变质,其化学方程式为 ,整个系统还必须与氧隔绝,其原因是 (用化学方程式表示)
(2)无机非金属材料是日常生活中不可缺少的物质,它们往往具有高强度、耐高温、耐腐蚀的特点。Si3N4就是一种重要的精细陶瓷,合成氮化硅的方法之一为: ,Si3N4属于原子晶体,在上述反应中氧化剂为
,Si3N4属于原子晶体,在上述反应中氧化剂为
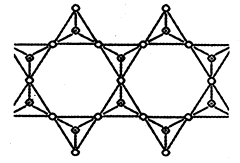
(3)硅酸盐中,SiO44-四面体通过共用顶角氧离子可形成链状、层状、空间网状等结构型式。下图为一种无限长双链结构的多硅酸根,其中Si原子的杂化形式为 ,该多硅酸根化学式为
(6分)已知2Na+2H2O====2NaOH+H2↑ ,该反应中氧化剂为 ,被氧化的物质是,若生成H2的体积为22.4L(标准状况),则该反应中
,被氧化的物质是,若生成H2的体积为22.4L(标准状况),则该反应中 转移到电子的物质的量为。
转移到电子的物质的量为。
3.01×1023个HCl分子的物质的量是,摩尔质量是,其在标准状况下的体积为,将其溶于水配成1L溶液,所得溶液的物质的量浓度为。
写出下列反应的离子方程式
(1)硫酸铜溶液与氢氧化钠溶液混合
(2)碳酸钠溶液与过量稀盐酸混合
写出下列物质在水溶液中的电离方程式
(1)氯化铜
(2)硫酸铁
(1)将AgNO3溶液分别与HCl、NaCl、KCl溶液混合,均有产生,它们的离子反应方程式。
(2)锌粒投入 稀硫酸中,溶液里离子的量减少,离子的量增加,离子的量没有变化.
稀硫酸中,溶液里离子的量减少,离子的量增加,离子的量没有变化.