反应  过程中的能量变化如图所示,回答下列问题。
过程中的能量变化如图所示,回答下列问题。

(1)该反应是反应(填"吸热""放热");
(2)当反应达到平衡时,升高温度,的转化率(填"增大""减小""不变"),原因是;
(3)反应体系中加入催化剂对反应热是否有影响?,原因是:
(4)在反应体系中加入催化剂,反应速率增大,和的变化是:,(填"增大""减小、""不变")。
(1)某温度时,在3 L密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示,由图中数据分析:
①该反应的化学方程式为:____________________。
②反应开始至2 min末,X的反应速率为________。
③该反应是由________________开始反应的(填“正反应”、“逆反应”或“正、逆反应同时”)。
(2)对于上述反应NH2CO2NH4(s) CO(NH2)2(s)+H2O(g) △H=+116.5 kJ·mol-1在密闭容器中将过量NH2CO2NH4固体于400K下分解,平衡时体系压强为a Pa,若反应温度不变,将体系的体积增加50%,则体系的压强是Pa(用含a的式子表示)。
CO(NH2)2(s)+H2O(g) △H=+116.5 kJ·mol-1在密闭容器中将过量NH2CO2NH4固体于400K下分解,平衡时体系压强为a Pa,若反应温度不变,将体系的体积增加50%,则体系的压强是Pa(用含a的式子表示)。
如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始时,V(A)=V(B)=a L。在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:
X+Y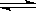 2Z+W△H<0(X、Y、Z、W均为气体),
2Z+W△H<0(X、Y、Z、W均为气体),
达到平衡时,V(A)=1.2aL,试回答:
(1)A中X的转化率α(A)=________;
(2)A、B中X转化率的关系:α(A)_________ α(B)(填“>”、“=”“<”);
(3)打开K,一段时间又达到平衡时,A的体积为_______L(连通管中气体体积不计)
反应aA(g)+bB(g)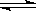 cC(g)+dD(g)在容积不变的密闭容器中达平衡,且起始时A和B的物质的量之比为a:b,则:
cC(g)+dD(g)在容积不变的密闭容器中达平衡,且起始时A和B的物质的量之比为a:b,则:
(1)平衡时,A、B转化率之比是_________。
(2)若同等倍数地增大A、B的物质的量浓度,使A与B转化率同时增大,(a+b)与(c+d)所满足的关系是___________。
(3)若a="2" b="1" c="3" d=2在甲、乙、丙、丁4个容器中A的物质的量依次是2mol、1mol、2mol、1mol,B物质的量依次是1mol、1mol、2mol、2mol,C、D物质的量均为0,则在同条件下达平衡时B的转化率由大→小顺序_________,A的转化率由大→小顺序__________。
在一定条件下,将2molA和2molB混合于容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)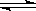 xC(g)+2D(g)。2min末反应达到平衡状态时,生成0.8molD,同时测得C的浓度为0.4mol/L。请填写下列空白:
xC(g)+2D(g)。2min末反应达到平衡状态时,生成0.8molD,同时测得C的浓度为0.4mol/L。请填写下列空白:
(1)x=______;用D的浓度变化表示的化学反应速率为_____________。
(2)A的平衡浓度为_______,B的转化率为__________。
(3)如果增大体系的压强,则平衡体系中C的体积分数将____(填“增大”“减小”或“不变”)。
(4)如果上述反应在相同条件下从逆反应开始进行,起始时加入C和D各 mol,要使平衡时各物质的体积分数与原平衡时完全相同,则还应加入______物质________mol。
mol,要使平衡时各物质的体积分数与原平衡时完全相同,则还应加入______物质________mol。
由等物质的量的X气体和Y气体组成的混合气体,在一定条件下进行反应:X(g)+Y(g) nZ(g) 经时间t后,产物Z气体在反应混合物中的物质的量百分数与温度的关系如图所示,经分析可知:
nZ(g) 经时间t后,产物Z气体在反应混合物中的物质的量百分数与温度的关系如图所示,经分析可知:
(1)该化学反应的正反应方向是_______热反应。
(2)T1表示该反应在时间t内可达平衡的_____(填“最高”或“最低”)温度。
(3)在T<T1的某一温度内,该反应______(填“能”或“不能”)建立平衡。
(4)在温度T2时增大压强,达新平衡时ω(Z)将增大,则系数n的值是_______,向_____移动。