氟苯水杨酸(diflu nisal)是一种新型的水杨酸类消炎解热镇痛良药,具有强效、长效低毒等特点。一种可行的合成路线如下(催化剂及溶剂等已省去):
nisal)是一种新型的水杨酸类消炎解热镇痛良药,具有强效、长效低毒等特点。一种可行的合成路线如下(催化剂及溶剂等已省去):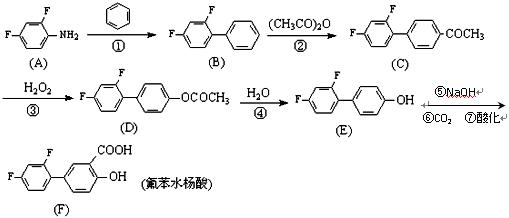
试回答下列问题:
(1)有关氟苯水杨酸的下列说法正确的是  (选填序号)。
(选填序号)。
A.分子中只含两种官能团
B.分子中所有原子可以处于同一平面
C.1mol氟苯水杨酸与足量的碳酸氢钠溶液反应,可生成2molCO2
D.在一定pH条件下,氟苯水杨酸遇FeCl3溶液能发生显色反应
E.在一定条件下,氟苯水杨酸能发生消去反应
(2)图中有机物(A)为2,4-二氟苯胺,它的化学式为 。
(3)上述反应中属于取代反应的有: (选填序号:①②③④)。
(4)反应②的方程式为:  。(不需注明反应条件)
。(不需注明反应条件)
(5)反应③有2种生成物,写出另一种生成物的化学式
醋酸是一种常见的弱酸,为了证明醋酸是弱电解质,某校研究性学习小组开展了题为“醋酸是弱电解质的实验研究”的探究活动。该校研究性学习小组设计了如下方案:
| A.先配制一定量的0.10 mol/L CH3COOH溶液,然后测溶液的pH,若pH大于1,则可证明醋酸为弱电解质 |
| B.先测0.10 mol/L CH3COOH溶液的pH,然后将其加热至40℃,再测pH,如果pH变小,则可证明醋酸为弱电解质 |
| C.先配制一定量0.01 mol/L和0.10 mol/L的CH3COOH溶液,分别测它们的pH,若两者的pH相差小于1个单位,则可证明醋酸为弱电解质 |
| D.在常温下,配制一定量的CH3COONa溶液,测其pH,若pH大于7,则可证明醋酸为弱电解质。 |
你认为上述方案可行的是________________________________。 一定温度下,有a、盐酸;b、硫酸;c、醋酸三种酸的稀溶液。(用a、b、c、<、=、>号填写)
①当其物质的量浓度相同时,c(H+)由大到小的顺序是_________,②同体积同物质的量浓度的三种酸,中和同物质的量浓度的NaOH消耗的体积由大到小的顺序是_________③当c(H+)相同、体积相同时,分别加入足量锌,相同状况产生的气体体积由大到小的顺序___________④将c(H+)相同的三种酸均稀释10倍,pH由大到小的顺序为_____________某温度(t ℃)时, KW=10-13,将此温度下pH=1的硫酸溶液aL与pH=12的氢氧化钡溶液bL混合。
①若所得混合液为中性,则a:b=。
②若所得混合液的pH=2,则a:b=。
(14分)具有支链的化合物A的分子式为C4H6O2,A可以使溴的四氯化碳溶液退色。1 mol A和1 mol NaHCO3能完全反应,则A的结构简是。
写出与A具有相同官能团的A的所有同分异构体的结构简式、
。化合物B含有C、H、O三种元素,相对分子质量为60,其中碳的质量分数为60%,氢的质量分数为13.3%。B在Cu的催化作用下被氧气氧化成C,C能发生银镜反应,则B的结构简式是。物质B的核磁共振氢谱(NMR)会产生个吸收峰,峰值比例为。
D是由A和B反应生成的酯,相应反应的化学方程式是______________
(10分) 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
请回答下列问题:A与银氨溶液反应有银镜生成,写出A被新制氢氧化铜悬浊液氧化成B的化学方程式:。
B→C的反应类型是。
E的结构简式是。
F和氢氧化钠溶液共热的化学反应方程式:
下列关于G的说法不正确的是()
a.能与溴单质反应 b.能与金属钠反应
c.1molG最多能和3mol氢气反应 d.分子式是C9H6O3
下图为牺牲阳极的阴极保护法的实验装置,此装置 中Zn电极上的电极反应为;如果将Zn换成Pt,一段时间后,在铁电极区滴入2滴黄色K3[Fe(CN)6](铁氰化钾)溶液时,烧杯中的现象是,发生的反应的离子方程式是。


CuI是一种不溶于水的白色固体,它可以由反应:2Cu2+ + 4I- = 2CuI↓ + I2而得到。现以石墨为阴极,以Cu为阳极电解KI溶液,通电前向电解液中加入少量酚酞和淀粉溶液。①电解开始不久,阴极产生的实验现象有,阴极的电极反应是。
②阳极区溶液变蓝色,同时伴随的现象还有,对阳极区溶液
呈蓝色的正确解释是。
| A.2I- - 2e- = I2;碘遇淀粉变蓝 |
| B.Cu - 2e- = Cu2+;Cu2+显蓝色 |
| C.2Cu + 4I-- 4e- =" 2CuI↓" + I2; 碘遇淀粉变蓝 |
| D.4OH-- 4e- = 2H2O + O2;O2将I-氧化为I2,碘遇淀粉变蓝 |
(1)现有如下两个反应:(A)NaOH + HCl =" NaCl" + H2O(B)Fe +H2SO4 = FeSO4 + H2 ↑;根据两反应本质,判断能否设计成原电池AB(填“能”或“不能”)
(2)根据下图填空
①负极为,该电极的方程式为
②正极的现象是,发生反应(填写“氧化”或“还原”)
③电子从经导线流向,溶液中H+向移动(填具体电极材料)。
④若反应过程中有0.1mol电子发生转移,则生成的氢气在标准状况下的体积为L。