(10分) 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
请回答下列问题:A与银氨溶液反应有银镜生成,写出A被新制氢氧化铜悬浊液氧化成B的化学方程式: 。
B→C的反应类型是 。
E的结构简式是 。
F和氢氧化钠溶液共热的化学反应方程式:
下列关于G的说法不正确的是( )
a.能与溴单质反应 b.能与金属钠反应
c.1molG最多能和3mol氢气反应 d.分子式是C9H6O3
(12分)过氧化钙晶体[CaO2·8H2O]较稳定,呈白色,微溶于水,能溶于酸性溶液。广泛应用于环境杀菌、消毒等领域。
Ⅰ.过氧化钙晶体的制备
工业上生产CaO2·8H2O的主要流程如下: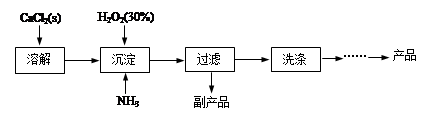

(1)用上述方法制取CaO2·8H2O的化学方程式是。
(2)沉淀时常用冰水控制温度在10℃以下,其可能原因分别是。
Ⅱ.过氧化钙晶体含量的测定
准确称取0.3000g产品于锥形瓶中,加入30 mL蒸馏水和10 mL 2.000 mol·L-1 H2SO4,用0.0200 mol·L—1KMnO4标准溶液滴定至终点。重复上述操作两次。H2O2和KMnO4反应的离子方程式为2MnO4-+5 H2O2+6H+ =2Mn2++5O2↑+8H2O
(3)滴定终点观察到的现象为。
(4)根据表1数据,计算产品中CaO2·8H2O的质量分数(写出计算过程)
| 滴定次数 |
样品的质量/g |
KMnO4溶液的体积/mL |
|
| 滴定前刻度/mL |
滴定后刻度/mL |
||
| 1 |
0.3000 |
1.02 |
24.04 |
| 2 |
0.3000 |
2.00 |
25.03 |
| 3 |
0.3000 |
0.20 |
23.24 |
托卡朋是基于2012年诺贝尔化学奖的研究成果开发的治疗帕金森氏病药物,《瑞士化学学报》公布的一种合路线如下: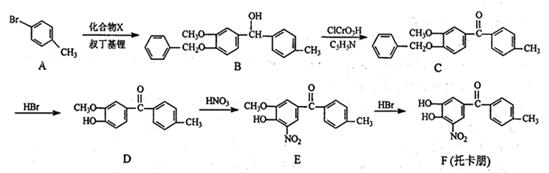
(1)B→C的反应类型 。
(2)化合物E中的含氧官能团有羰基、酚羟基、 和 (填官能团名称)。
(3)写出同时满足下列条件的D的一种同分异构体的结构简式 。
①含有2个苯环
②碱性水解生成的一种无机盐和一种有机盐;酸化后得到的有机物有4种不同化学环境的氢.
(4)实现A→B的转化中,叔丁基锂[(CH3)CLi]转化为((CH3)2C=CH2,同时有LiBr生成,则X(分子式为C15H14O3)的结构简式为 。
(5)已知: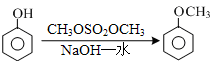 结合流程信息,写出以对甲基苯酚和硫酸二甲酯(
结合流程信息,写出以对甲基苯酚和硫酸二甲酯(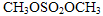 )为原料,制备
)为原料,制备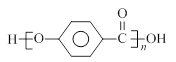 的合成路线流程图(无机试剂任用)。
的合成路线流程图(无机试剂任用)。
合成路线流程图示例如下:
海水综合利用的工艺流程图如下: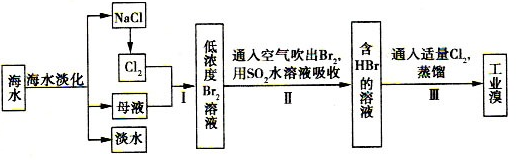
(l)步骤II用SO2水溶液吸收Br2,吸收率可达95%。
①有关反应的离子方程式为;
②该过程中除环境保护外,在工业生产中应解决的主要问题是;
(2)步骤I中已获得Br2,步骤II中又将Br2还原为Br-,其目的是;实验室中采用方法可以起到同样的作用。
(3)分离出粗盐后的海水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品。从海水中提取镁的步骤为:
a.将海边大量存在的贝壳锻烧成石灰,并将石灰制成石灰乳;
b.将石灰乳加人海水沉淀池中经过滤得到Mg(OH)2沉淀;
c.在Mg(OH)2沉淀中加人盐酸得到MgCl2溶液,再经蒸发结品得到MgCl2· 6H2O;
d.将MgCl2·6H2O在氯化氢氛围下加热得到无水MgCl2.电解熔融的氯化镁可得到Mg。
①写出直接加热MgCl2·6H2O的化学方程式;
②有同学认为:步骤b后可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,这样可简化生产步骤,体现简约性原则:你是否同意该同学的想法并说明理由:。
有机物F的合成路线如图所示:
已知以下信息:
(1)RCOOR’ RCH2OH
RCH2OH
(2)
回答以下问题:
(1)A的结构简式为,G的结构简式为。
(2)B生成C的化学方程式为。
(3)检验E中含氧官能团的试剂是,现象是。
(4)E→F的反应类型是。
(5)A的同分异构体中,符合下列条件的同分异构体有种(不包含A),写出其中一种的结构简式。
①属于芳香族化合物
②苯环上有四个取代基
③苯环上的一溴取代物只有一种
X、Y、Z、W、Q五种前四周期元素,原子序数依次增大。已知五种元素中只有一种为金属元素,XW2分子与Y3-为等电子体,元素W的原子序数等于元素Z的原子序数加8,Q的最外层电子数为2,次外层电子数等于Y和W2-最外层电子数之和。根据以上信息回答下列问题:
(1)X、Y、Z的电负性由大到小的顺序为。
(2)XW2的电子式为,Y3-的分子构型为型。
(3)Q的价电子排布式为。
(4)下列关于WZ2结构的说法正确的是
| A.WZ2为直线型非极性分子 | B.WZ2为直线型极性分子 |
| C.WZ2中W为sp3杂化 | D.WZ2中W为sp2杂化 |
(5)α-QW的晶胞是立方体,用X射线粉末法测得该晶体晶胞边长a=520.0pm,26℃测得该晶体的密度为4.1g/cm3,请列式计算一个晶胞中含有的Q、W离子数。
(6)α-QW晶胞的一个侧面的投影图如右图所示,与Q离子距离最近且距离相等的W离子构成的几何图形是。