一定温度下,在容积固定的V L密闭容器中加入n mol A、2n mol B,发生反应:A(g)+2B(g) 2C(g) ΔH>0,反应达平衡后测得平衡常数为K,此时A的转化率为X。
2C(g) ΔH>0,反应达平衡后测得平衡常数为K,此时A的转化率为X。
(1)一段时间后上述反应达到平衡。则下列说法中不正确的是________(填字母)。
A.物质A、B的转化率之比为1∶1
B.起始时刻和达到平衡后容器中的压强之比为3∶(3-x)
C.充入惰性气体(如Ar),平衡向正反应方向移动
D.当2v正(A)=v逆(B)时,反应一定达到平衡状态
(2)K和x的关系满足K=____________。
(3)该反应的逆反应速率与时间的关系
如图所示。
①由图可知,反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的条件:
t2时_________________________; t8时_________________________。
②t2时平衡向__________(填“正反应”或“逆反应”)方向移动。
③若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系线。
请仔细阅读以下转化关系: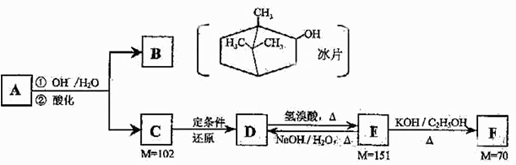
A是从蛇床子果实中提取的一种中草药有效成分,是由碳、氢、氧元素组成的酯类化合物;
B称作冰片,可用于医药和制香精,樟脑等;
C的核磁共振氢谱显示其分子中含有4种氢原子;
D中只含一个氧原子,与Na反应放出H2;
F为烃。
请回答:
(1)B的分子式为。
(2)B不能发生的反应是(填序号)。
a.氧化反应 b.聚合反应 c.消去反应 d.取代反应 e.与Br2加成反应.
(3)写出D→E、E→F的反应类型:D→E、E→F。
(4)F的分子式为。化合物H是F的同系物,相对分子质量为56,写出H所有可能的结构;。
(5)写出A、C的结构简式并用系统命名法给F命名:
A:_、C:、F的名称:。
(6)写出E→D的化学方程式。
已知X、Y、Z、M、Q、G、R、T,前四周期的8种元素(未按照原子序数排列),Z元素的某种氢化物可用作火箭的燃料;Q元素的单质为绿色植物光合作用的一种产物;根据化学对角线法则,G元素对角线的另一种元素T的单质可溶于R元素最高价氧化物所对应水溶液中并且目前易拉罐包含G元素最多;Y元素的价电子排布式为(n+1)Sn (n+1)P(n+3); X元素某种的盐溶液可以与M元素的单质发生反应,并能生成X元素的单质,且两者核电荷数相差3,且M元素的单质是地壳含量第二高的金属元素;R元素为第三周期的某种元素。
(1)写出X元素的价电子排布式,Z元素对应的最简单氢化物的空间构型。
(2)写出元素T的单质可溶于R元素最高价氧化物所对应水溶液对应的离子方程式:
。
(3)Q元素所对应的氢化物的沸点比同主族元素所对应氢化物沸点高的原因是:
。
(4)生活中,应将含Y、Q元素的某种粉末状物质密封、避光、干燥保存,且该粉末状物质经常在洗衣服时用到,请用化学方程式说明,该物质敞放在空气失效的原因:
。
(5)Z元素的某种氢化物,可用作火箭燃料,且该化合物中Z原子与氢原子的个数比为1:2,工业上用尿素和漂白液的主要有效成分,在R元素最高价氧化物所对应水溶液中并用高锰酸钾作为催化剂反应生成这种名为水合氨的化合物,生成的其它产物中某种离子,可以与CaCl2溶液反应生成某种白色沉淀,大理石中主要含这种成分。通过以上资料,写出该化学方程式:
。
(6)若取M元素的某种氧化物于试管中,加入稀盐酸调pH约为7,加入淀粉-KI溶液和Q元素的某种化合物,且该化合物的空间构型为异面折线形,反应完后溶液呈蓝色并有红褐色沉淀生成。当消耗2mol I-时,共转移3mol电子,该反应的离子方程式:
。
合成口服抗菌药琥乙红霉素片的原料G、某种广泛应用于电子领域的高分子化合物I的合成路线如下:
已知:① R—CH2—CH=CH2 R—CHCl—CH=CH2
R—CHCl—CH=CH2
②R—CH2—CH=CH2 R—CH2CH2CH2CHO
R—CH2CH2CH2CHO
(1)C的结构简式是,E中的官能团的名称是。
(2)写出A B的反应方程式,该反应类型是。
B的反应方程式,该反应类型是。
(3)H的分子式为C8H6O4,能与碳酸钠溶液反应放出气体,其一氯取代物只有一种,试写出E+H I的反应方程式。
I的反应方程式。
(4)关于G的说法中错误的是 (填序号)。
a.1 mol G最多可与2 mol NaHCO3反应
b.G可发生消去反应
c.1 mol G最多可与2 mol H2发生加成反应
d.1 mol G在一定条件下可与2 mol乙醇发生取代反应
钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”。试回答下列问题:
(1)钛有 和
和 两种原子,它们互称为,钛基态原子的电子排布式为;
两种原子,它们互称为,钛基态原子的电子排布式为;
(2)偏钛酸钡在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构如图所示,它的化学式是;
(3)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如下:
化合物甲的分子中采取sp2杂化的碳原子个数为,化合物乙中采取sp3杂化的原子的第一电离能由大到小的顺序为。
(4)现有含Ti3+的配合物,化学式为[TiCl(H2O)5]Cl2·H2O。配离子[TiCl(H2O)5] 2+中含有的化学键类型是,该配合物的配体是。
在自来水消毒和工业上砂糖、油脂的漂白与杀菌过程中,亚氯酸钠(NaClO2)发挥着重要的作用。下图是生产亚氯酸钠的工艺流程图:
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O;
②常温下,Ksp(FeS)=6.3×10-18;Ksp(CuS)=6.3×10-28;Ksp(PbS)=2.4 ×10-28
(1)反应I中发生反应的离子方程式为。
(2)从滤液中得到NaClO2·3H2O晶体的所需操作依次是(填写序号)。
a.蒸馏 b.蒸发浓缩c.过滤 d.冷却结晶 e.灼烧
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2。下表是25℃时HClO2及几种常见弱酸的电离平衡常数:
| 弱酸 |
HClO2 |
HF |
H2CO3 |
H2S |
| Ka/mol·L-1 |
1×10-2 |
6.3×10-4 |
K1=4.30×10-7 K2=5.60×10-11 |
K1=9.1×10-8 K2=l.1×10-12 |
①常温下,物质的量浓度相等的NaClO2、NaF、NaHCO3、Na2S四种溶液的pH由大到小的顺序为(用化学式表示);体积相等,物质的量浓度相同的NaF、NaClO2两溶液中所含阴阳离子总数的大小关系为:(填“前者大”“相等”或“后者大”)。
②Na2S是常用的沉淀剂。某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是;常温下,当最后一种离子沉淀完全时(该离子浓度为10-5mol·L-1)此时体系中的S2-的浓度为。
(4)Ⅲ装置中生成气体a的电极反应式,若生成气体a的体积为1.12L(标准状况),则转移电子的物质的量为。