(1)现有如下两个反应:(A)NaOH + HCl =" NaCl" + H2O(B)Fe +H2SO4 = FeSO4 + H2 ↑;根据两反应本质,判断能否设计成原电池A B (填“能”或“不能”)
(2)根据下图填空
①负极为 ,该电极的方程式为
②正极的现象是 ,发生 反应(填写“氧化”或“还原”)
③电子从 经导线流向 ,溶液中H+向 移动(填具体电极材料)。
④若反应过程中有0.1mol电子发生转移,则生成的氢气在标准状况下的体积为 L。
19g某二价金属氯化物(ACl2)中含有0.4 mol Cl ,则ACl2的摩尔质量是;A的相对原子质量是;ACl2的化学式是。
,则ACl2的摩尔质量是;A的相对原子质量是;ACl2的化学式是。
下表是某种常见金属的部分性质:
| 颜色状态 |
硬度 |
密度 |
熔点 |
导电性 |
导热性 |
延展性 |
| 银白色固体 |
较软 |
2.70 g·cm-3 |
660.4 ℃ |
良好 |
良好 |
良好 |
将该金属投入冷水中无变化,投入稀盐酸中,可产生大量的无色气体。根据上述信息完成下列问题:
(1)试推断该金属可能的一种用途________,该金属的活动性比铜_____________(填“强”或“弱”)。(2)请自选试剂,设计实验探究该金属与铁的活动性强弱,并完成下表:
| 猜想 |
验证方法 |
实验现象 |
| 该金属比铁活泼 |
||
| 该金属活泼性比铁弱 |
粉末状样品A是由等物质的量的MgO和Al2O3与常见金属氧化物B组成的混合物。A有如下图所示的转化关系。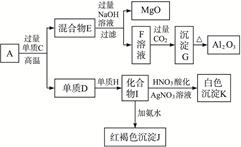
请完成下列问题:
(1)单质C和H的化学式分别是__________、__________。
(2)写出由I生成J的离子方程式:_____________。
(3)写出由F生成G的离子方程式:________。
(4)若10.7 g样品A中MgO、Al2O3和B的物质的量均为0.05 mol,则B的化学式为_________。
(5)若B中金属原子与氧原子的粒子数之比为2∶3,取7.10 g样品A,恰好与含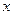 mol HCl的盐酸完全反应,则
mol HCl的盐酸完全反应,则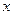 的取值范围是___________(保留小数点后两位)。
的取值范围是___________(保留小数点后两位)。
据说古代有一队运输纯碱的车队,夜晚在沙滩上用纯碱块和石块打起炉灶烧火做饭,第二天清晨日出时,在炉灶处发现有些明晃晃的东西
(1)你认为明晃晃的东西是______________。
(2)写出整个过程中的化学方程式:____________。
(8分)已知甲元素是第三周期p区元素,其最低氧化值为-1,乙元素是第四周期d区元素,其最高氧化值为+4,试填下表:
| 元素 |
价电子构型 |
族 |
金属或非金属 |
电负性相对高低 |
| 甲 |
||||
| 乙 |