莽草酸是合成治疗禽流感的药物—达菲(Tamiflu)的原料之一。莽草酸是A的一种异构体。A的结构简式如右图: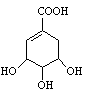
请回答:
(1)写出A分子中官能团的名称 。
(2)该有机物分子1mol最多能和 molNaOH发生反应。
以下是以A为原料的有机合成路线:
已知D的碳环上一氯代物只有两种。回答下列问题:
(3)C有三种结构,写出其中一种的结构简式: 。
(4)A→D的反应类型为 。
(5)写出下列反应的化学方程式:
① D与足量的NaHCO3溶液反应: 。
②D→E: 。
有A、B、C、D 四种化合物,分别由K+、Ba2+、SO42-、CO32-、OH-中的两种组成,它们具有下列性质:①A不溶于水和盐酸;②B不溶于水,但溶于盐酸,并放出无色无刺激性气味的气体E;③C的水溶液呈碱性,与硫酸反应生成A;④D可溶于水,与硫酸作用时放出气体E,E可使澄清石灰水变浑浊。
(1)推断A、B、C、D、E的化学式。
A;B;C;D;E
(2)写出下列反应的离子方程式。
B与盐酸反应
C与硫酸反应
D与硫酸反应
E与澄清石灰水反应
对反应3Cl2 + 8NH3== 6 NH4Cl + N 2
(1)该反应中的氧化剂是__________ ,被氧化的元素是。
(2) 1 mol Cl2参加反应,被氧化的NH3的物质的量是mol。
(3) 标出该反应中电子转移情况 。
(4) 若有68g NH3参加反应,电子转移的物质的量是mol。
下列物质中,物质的量最大的是________(填序号,下同),含分子个数最多的是________,含原子个数最多的是________,质量最大的是________。
| A.92 g乙醇(C2H5OH); | B.0.5 mol CO2; | C.148 g H2SO4; |
| D.6 g H2; E.1.204×1024个HCl分子; F.4 ℃时10 mL水 |
100 mL 0.1 mol·L-1 Ba(OH)2溶液与50 mL 0.1 mol·L-1 Na2CO3溶液混合后,边滴边振荡,逐滴加入0.1 mol·L-1 HCl至pH等于7,则需要加入盐酸的体积为_____________mL;如果再加入0.1 mol·L-1酸化的AgNO3溶液至Cl-刚好完全沉淀,则需要加入AgNO3溶液的体积为_____________mL。
用中和滴定的方法测定NaOH和Na2CO3混合溶液中NaOH的含量时,可先在混合溶液中加入过量的氯化钡溶液,使Na2CO3完全变成BaCO3沉淀,然后用标准盐酸滴定(用酚酞作指示剂)。试完成下列问题:
(1)向混有BaCO3沉淀的NaOH溶液中滴入盐酸,为什么不会使BaCO3溶解而能测定NaOH的含量?_______________________________________________________________________。
(2)滴定终点时溶液颜色如何变化?______________________________________________。
(3)滴定时,若滴定管中滴定液一直下降到活塞处才到达终点,能否据此得出准确的滴定结果_______________(填“能”或“不能”)。
(4)能否改用甲基橙作指示剂(填“能”或“不能”) _______________,如果用甲基橙作指示剂,则测定结果如何?_______________(填“偏高”“偏低”或“正确”)。