X、Y、Z、W是短周期的四种元素,有关他们的信息如下表所示。
| 元素 |
部分结构知识 |
部分性质 |
| X |
X的单质由双原子分子构成,分子中有14个电子 |
X有多种氧化物,如XO、XO2、X2O4等;通常情况下XO2与X2O4共存 |
| Y |
Y原子的次外层电子数等于最外层电子数的一半 |
Y能形成多种气态氢化物 |
| Z |
Z原子的最外层电子数多于4 |
Z的最高正化合价与最低负化合价代数和为6 |
| W |
W原子的最外层电子数等于2n-3(n为原子核外电子层数) |
化学反应中W原子易失去最外层电子形成Wn+ |
填写下列空白:(提示:不能用字母X、Y、Z、W作答)
(1)X的气态氢化物分子的电子式是 ,Z元素在周期表中的位置是 。
(2)X、Y、Z三元素的最高价氧化物的水化物酸性由强到弱的顺序是 。
(3)常温时,W的硫酸盐溶液的pH 7(填“=”、“>”或“<”),理由是: (用离子方程式表示)。
(4)实验室用X的氢化物的水溶液制取W的氢氧化物的方法是(用离子方程式表示)
。
(5)25℃、101 kPa时,32 g Y的最低价气态氢化物完全燃烧生成稳定的氧化物时放出1780.6 kJ的热量,写出该反应的热化学方程式 。
乙醇是重要的化工原料和液体燃料,可以在一定条件下利用CO2与H2反应制得:
请回答:
(1)该反应的化学平衡常数表达式为。
(2)当温度T1>T2时,化学平衡常数K1K2(填“>”、“<”或“=”)。
(3)在恒温、恒容的密闭容器中,下列描述能说明上述反应已达化学平衡状态的是(填字母序号)。
a.生成1molCH3CH2OH的同时生成3 mol H2O
b.容器中各组分浓度不随时间而变化
c.容器中混合气体的密度不随时间而变化
d.容器中气体的分子总数不随时间而变化
(4)在工业生产中,可使H2的转化率和化学反应速率同时提高的措施有(写出一条合理措施即可)。
(5)工业上,常以乙醇为原料生产乙醛。根据下图所示信息,该反应是反应(填“放热”或“吸热”),判断依据是__________________。
(6)乙醇可以作为燃料电池的燃料。某乙醇燃料电池以乙醇为燃料,使用酸性电解质,该电池负极反应的电极反应式为。
为了探究原电池和电解池的工作原理,某研究性学习小组分别用下图所示的装置进行实验。据图回答问题。

I.用图甲所示装置进行第一组实验时:
(1)在保证电极反应不变的情况下,不能替代Cu作电极的是(填序号)。
| A.石墨 | B.镁 | C.银 | D.铂 |
(2)实验过程中,SO42−(填“从左向右”“从右向左”或“不”)移动;滤纸上能观察到的现象。
II.该小组同学用图乙所示装置进行第二组实验时发现,两极均有气体产生,且Y极溶液逐渐变成紫红色:停止实验观察到铁电极明显变细,电解液仍然澄清。查阅资料知,高铁酸根(FeO42-)在溶液中呈紫红色。请根据实验现象及所查信息,回答下列问题:
(3)电解过程中,X极溶液的pH(填“增大”“减小”或“不变”)
(4)电解过程中,Y极发生的电极反应为4OH−-4e−=2H2O+O2↑和。
(5)电解进行一段时间后,若在X极收集到672mL气体,Y电极(铁电极)质量减小0.28g,则在Y极收集到气体为mL(均已折算为标准状况时气体体积)。
(6)K2FeO4—Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电池反应为:
2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的电极反应式为。
(Ⅰ)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为:CO(g)+2H2(g) CH3OH(g) △H
CH3OH(g) △H
已知某些化学键的键能数据如下表:
| 化学键 |
C—C |
C—H |
H—H |
C—O |
C≡O |
H—O |
| 键能/kJ·mol-1 |
348 |
413 |
436 |
358 |
1072 |
463 |
请回答下列问题:
(1)已知CO中的C与O之间为叁键连接,该反应的△H=;
(2)某化学研究性学习小组模拟工业合成甲醇的反应,在容积固定为2L的密闭容器内充入1molCO和2molH2,加入合适催化剂(体积可以忽略不计)后在250°C开始反应,并用压力计监测容器内压强的变化如下:
| 反应时间/min |
0 |
5 |
10 |
15 |
20 |
25 |
| 压强/MPa |
12.6 |
10.8 |
9.5 |
8.7 |
8.4 |
8.4 |
则从反应开始到20min时,以CO表示的平均反应速率=,该温度下平衡常数K=,若升高温度则K值(填“增大”、“减小”或“不变”);
(3)下列描述中能说明上述反应已达平衡的是;
A.2v(H2)正=v(CH3OH)逆
B.容器内气体的平均摩尔质量保持不变
C.容器中气体的压强保持不变
D.单位时间内生成nmolCO的同时生成2nmolH2
(Ⅱ)回答下列问题:
(1)体积均为100ml pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则Ka(HX) ______ Ka(CH3COOH)(填>、<或=)
(2)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中C(CH3COO−)-c(Na+)=____________mol·L-1(填精确值)。
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号)。
(2)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质(写分子式)。
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系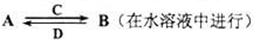
其中C是溶于水显酸性的气体;D是淡黄色固体。写出C的结构式;D的电子式。
①如果A、B均由三种元素组成,B为两性不溶物,则A的化学式为;
由A与过量的C反应转化为B的离子方程式。
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因。A、B浓度均为0.1mol/L的混合溶液中,离子浓度由大到小的顺序是。
氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇,熔点422 ℃,沸点1366 ℃,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。以粗盐水(含Ca2+、Mg2+、SO42-等杂质)、Cu、稀硫酸、SO2等为原料合成CuCl的工艺如下: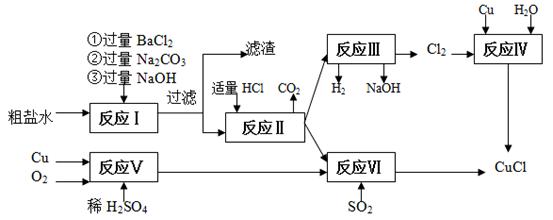
(1)在粗盐除杂的反应I中加Na2CO3溶液的作用是;
滤渣的主要成分:。
(2)反应Ⅱ完成后溶液中主要溶质是。
(3)反应IV和VI都是制备CuCl的化学过程:
①反应IV加入的Cu必须过量,其目的是。
②写出反应VI的离子方程式。
(4)反应VI后,过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70 ℃干燥2小时,冷却,密封包装即得产品。于70℃真空干燥的目的是。