含有下列离子的五种溶液①Ag+ ②Mg2+ ③Al3+ ④ Fe2+ ⑤Fe3+ 试回答下列问题:
(1)既能被氧化又能被还原的离子是____________(填离子符号,下同)
(2)向④中加入NaOH溶液,现象是 有关化学方程式为
、 。
(3)加入过量NaOH溶液无沉淀的是_____________
(4)加铁粉溶液质量增重的是_________,溶液质量减轻的___________
(5)遇KSCN溶液呈红色的是_________________________
(6)能用来鉴别Cl–存在的离子是___________
(1)光导纤维是一种能高质量传导光的玻璃纤维,利用光缆通讯,能同时传输大量信息。制造光纤电缆的主要原材料的化学式是 ,它属于
材料。
(2)有些烟幕弹产生烟幕的原理是应用了水解反应。水解反应是一类广泛存在的反应,如PCl3、SiCl4易水解,PCl3的水解反应为PCl3+4H2OH3PO4+5HCl。现代海战中,常常通过喷放SiCl4和液氨产生大量烟幕,所涉及反应的化学方程式是。
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖的漂白剂和杀菌。以下是用过氧化氢法生产亚氯酸钠的工艺流程图: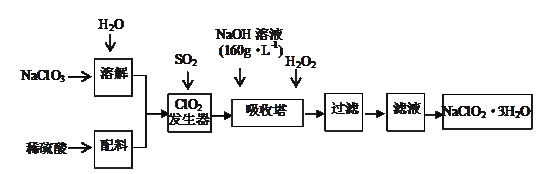
已知:NaOH溶液(160g·L-1)是指每升溶液中含溶质160 g。
试回答下列问题:
(1)该NaOH溶液的物质的量浓度为。
(2)在吸收塔中,ClO2、NaOH与H2O2反应生成NaClO2和O2,则该反应中还原剂与氧化剂的物质的量之比为。
(3)NaClO2较稳定,但其固体在加热时或敲击时会立即发生爆炸,其爆炸后的产物可能是
(填字母)
| A.NaCl、Cl2 | B.NaCl、NaClO | C.NaClO3、NaClO4 | D.NaCl、NaClO3 |
(4)NaClO3与SO2反应生成ClO2,写出该反应的化学方程式,并用单线桥标出电子转移的方向和数目:。
(10分)现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各离子不重复):
| 阳离子 |
H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 |
OH-、Cl-、CO32-、NO3-、SO42- |
各取五种溶液分别做了如下实验
(1)用PH试纸测出A、B溶液呈碱性,C、D、E溶液呈酸性
(2)A溶液与E溶液反应既有气体产生又有沉淀产生;A溶液与C溶液反应只有气体产生
(3)D溶液与另外四种溶液反应都能产生沉淀;C溶液只能与D溶液反应产生沉淀则各物质分别是(写化学式):A、B、C、
D、E。
资料1:精制碘盐的成分为NaCl和KIO3,其中碘的含量为20~40mg·kg-1。
资料2:日本地震导致福岛两座核电站反应堆发生故障,铯和碘的放射性同位素大量外泄。
资料3:专家认为,每天服用1片碘片(含碘量100mg)可有效减小人体甲状腺对放射性碘的吸收。
请认真阅读以上资料,并回答下列问题:
(1)铯在周期表中的位置是。
(2)下列物质中与KIO3属于同一类物质的是(填序号)。
①HIO3②碘酸钠③KOH④I2O5⑤NaCl
(3)向碘盐的溶液中加入白醋和KI,再滴入淀粉溶液,溶液呈蓝色,则发生反应的离子方程式为。
(4)若用精制碘盐来预防放射性碘对人体的伤害,是否可行?(填“行”、“不行”),原因是。
(12分)工业上,以钛铁矿为原料制备二氧化钛的工艺流程如下图所示。钛铁矿主要成分为钛酸亚铁(FeTiO3),其中一部分铁元素在风化过程中会转化为+3价。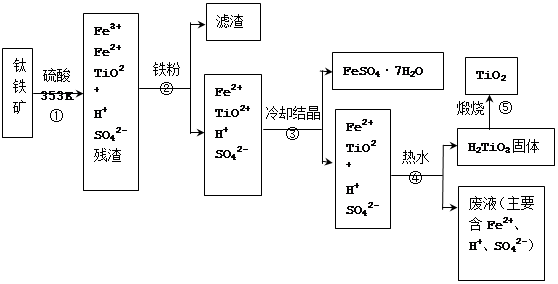
已知:TiOSO4遇水会水解。
(1)步骤②中,用铁粉将Fe3+转化为Fe2+的反应的离子方程式为。
(2)步骤③中,实现混合物的分离是利用物质的(填字母序号)。a. 熔沸点差异 b. 溶解性差异 c. 氧化性、还原性差异
(3)步骤②、③、④中,均需用到操作是(填操作名称)。
(4)可以利用生产过程中的废液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4,易溶于水),则反应的离子方程式为。
(5)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用下图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。
①写出阳极所发生反应的电极反应式:。
②在制备金属钛前后,CaO的总量不变,其原因是
(请结合化学用语解释)