某同学设计了测定镀锌铁皮锌镀层的厚度的实验方案:将单侧面积为S、质量为m1的镀锌铁皮放入6mol/LHCl溶液中,当气泡产生速率显著减小时,取出铁片,用水冲洗,烘干称量,称得的质量为m2。下列说法不正确的是
| A.当铁片产生气泡速率减慢时,立即取出铁片,不冲洗就用酒精灯加热烘干,铁片可能继续与残留的酸反应,导致实验结果偏高 |
| B.试验中产生气泡的速率是先慢,然后逐渐加快,再显著减慢,这是微电池和温度共同影响的结果 |
| C.锌和铁在酸溶液中形成原电池,外电路中电流从铁流向锌。 |
| D.设锌镀层为h,锌的密度为ρ,则h = (m1— m2)/2ρS |
下列关于砹(85At)及其化合物的说法中,正确的是( )
| A.稳定性:HAt>HCl | B.氧化性:At2>I2 |
| C.At2为分子晶体 | D.NaAt的水溶液呈碱性 |
将1 mol H2(g)和2 mol I2 (g)置于某2L密闭容器中,在一定温度下发生反应:H2(g)+I2(g) 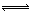 2HI(g);ΔH<0 ,并达到平衡。HI的体积分数ω(HI)随时间变化如图(Ⅰ)所示,若改变反应条件,ω(HI)的变化曲线如图(Ⅱ)所示,则改变的条件可能是 ()
2HI(g);ΔH<0 ,并达到平衡。HI的体积分数ω(HI)随时间变化如图(Ⅰ)所示,若改变反应条件,ω(HI)的变化曲线如图(Ⅱ)所示,则改变的条件可能是 ()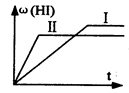
| A.恒温条件下,加入适当催化剂 | B.恒温,恒容下,充入氦气 |
| C.恒容条件下升高温度 | D.恒温,恒压下,充入氦气 |
A、B、C短周期元素在周期表中的位置如图所示,已知A、C可分别与B形成化合物x和y,A与B的质子数之和为C的质子数,现有以下说法,其中判断正确的组合是( )
①B与C均存在同素异形体 ②x的种类比y的多 ③常温下,B氢化物中无H+
④C的最高价氧化物对应水化物能与A的氢化物形成三种盐
A.①②③④ B.②③ C.①②④ D.①④
设NA为阿伏加德罗常数的数值,下列说法错误的是()
| A.NA个Fe(OH)3胶体粒子的质量为107g |
| B.0.1 mol铁在0.1 mol Cl2中充分燃烧,转移的电子数为0.2 NA |
| C.24 g NaH中阴离子所含电子总数为2 NA |
| D.标准状况下,22.4 LCO2和O2混合气体中含有的氧原子数为2NA |
下列说法正确的是()
| A.宏观上的物质对外不显电性,是因为组成它们的微观粒子都是电中性的原子和分子 |
| B.某物质经科学测定只含有一种元素,则可以断定该物质是一种纯净物 |
| C.利用化学方法,我们可以制造出新的分子,但不能制造出新原子 |
| D.由两种元素组成的电解质分子中,显正价的是阳离子,显负价的是阴离子 |