有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数, 且A的L层电子数是K层电子数的两倍, C在空气中燃烧时呈现黄色火焰, C的单质在高温下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物。
试根据以上叙述回答:
(1)元素名称: A ______ B _____ C _____ D ______。
(2)D元素位于周期表中 周期 族。
(3)写出AB2与C2B2反应的化学方程式 。
(4)画出B的原子结构简图 ___________________。
(5)用电子式表示化合物 C2D 的形成过程: 。
图一是煤化工产业链的一部分,试运用所学知识,回答下列问题: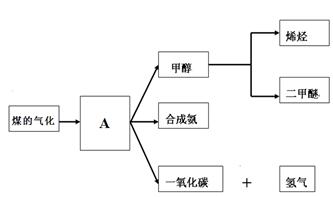
图一
(1)图一中气体A的俗称是_______________
(2)合成氨工业是煤化工产业链中非常重要的一步。已知有一组数据:破坏1mol氮气中的化学键需要吸收946 kJ能量;破坏0.5mol氢气中的H-H键需要吸收218kJ的能量;形成氨分子中1 mol N-H键能够释放389kJ能量。图二表示合成氨工业过程中能量的变化,请将图中①、②的能量变化的数值,填在下边的横线上。 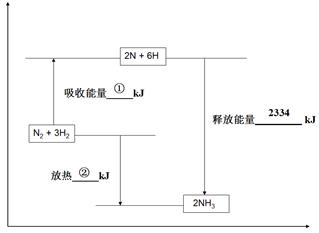
图二
①kJ ,②kJ
(3)煤化工产业的重要产品之一甲醇,是一种新型的汽车动力燃料,发达国家等一般通过CO和H2化合制备甲醇,该反应的化学方程式为:CO (g) + 2H2(g) CH3OH(g)
CH3OH(g)
①下列描述中能说明上述反应已达平衡的是_______;
A. 容器内气体的平均摩尔质量保持不变
B. 2v(H2)正 = v(CH3OH)逆
C. 容器中气体的压强保持不变
D. 单位时间内生成n molCO的同时生成2n mol H2
②在容积固定的恒温密闭容器中充入CO和H2发生上述反应,反应在第4 min时候达到其限度,此时容器中压强与反应前之比为3︰5,容器内物质的各种物质的量浓度如下表:
| 时间/浓度 |
c(CO)(mol/L) |
C(H2 )(mol/L) |
c(CH3OH)(mol/L) |
| 起始 |
0.200 |
0.300 |
0.000 |
| 第4 min |
a |
b |
c |
则b=__________________
(4)甲醇—空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,其工作原理如下图所示,该燃料电池的电池反应式为2CH3OH (g) + 3O2(g) = 2CO2(g) + 4H2O(l),则负极的电极反应式为______________________,正极附近pH值_______________(填写“增大”、“减小”或者“不变”)
下表是元素周期表一部分,列出了十个元素在周期表中的位置:
| 族 周期 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
| 2 |
⑥ |
⑦ |
||||||
| 3 |
① |
③ |
⑤ |
⑧ |
⑩ |
|||
| 4 |
② |
④ |
⑨ |
请用化学用语回答下列问题
(1)在③~⑦元素中,原子半径最大的是 (填元素符号);
(2)①~⑩中元素最高价氧化物对应的水化物中酸性最强的是(填物质化学式),呈两性的氢氧化物是(填物质化学式);
(3)⑦元素的最高价氧化物对应水化物与其氢化物能生成盐M,M中含有的化学键类型有;
(4)用电子式表示元素③与⑧形成化合物的过程。
(5)写出含有32个电子的元素⑥的氢化物的分子式:。
(6)写出工业冶炼⑤的化学方程式:
(7)写出将⑨元素单质从海水中(离子形式存在)提取所涉及到的三个步骤的离子方程式,第一步:Cl2+2Br-=2Cl-+Br2 第二步:; 第三步Cl2+2Br-=2Cl-+Br2
化学学科中的平衡理论主要包括:化学平衡、电离平衡和水解平衡三种,且均符合勒夏特列原理。请回答下列问题:
Ⅰ、在恒容密闭容器中,发生反应3A(g)+B(g) 2C(g) ΔH=Q kJ/mol。回答下列问题:
2C(g) ΔH=Q kJ/mol。回答下列问题:
(1)写出该反应平衡常数的表达式__________。
(2)下列各项能作为判断该反应达到化学平衡状态的依据是________(填序号)。
① v(A)=3v(B)②混合气体的密度保持不变
③有3 mol A消耗的同时有1 mol B生成 ④C的浓度保持不变
(3)根据实验测得的数据可知,温度越高该反应的化学平衡常数越大,则Q______0(填“大于”或“小于”)。
Ⅱ、(1)室温下,取pH=2的盐酸和醋酸溶液各100 mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是________(填 “a”或“b”)。设盐酸中加入Zn质量为m1,醋酸溶液中加入的Zn质量为m2,则m1________m2(选填“<”、“=”或“>”)。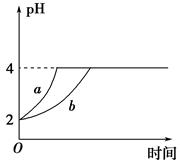
(2)若室温下pH=2的盐酸和醋酸溶液各 100 mL,分别加水稀释后使pH=4,设盐酸中加入水的体积为V1,醋酸溶液中加入的水的体积为V2,则 V1______V2(填“<”“=”或“>”)。
Ⅲ、常温下,浓度均为0.1 mol/L 的下列六种溶液的pH如下表:
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
C6H5ONa |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
11.3 |
(1)上述盐溶液中的阴离子,结合H+能力最强的是
(2)根据表中数据判断,浓度均为0.01 mol/L 的下列五种物质的溶液中,酸性最强的是_______ (填编号) ; 将各溶液分别稀释100倍, pH变化最小的是(填编号) 。
A.HCN B.HClO C.C6H5OH D.CH3COOH E.H2CO3
(3)据上表数据,请你判断下列反应不能成立的是 (填编号)。
A.CH3COOH+ Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2C6H5 ONa=Na2CO3+2C6H5OH
Ⅳ、已知:ZnCl2·xH2O易溶于水,且其浓的水溶液呈较强酸性;SOCl2 (氯化亚砜)极易和水发生如下反应:SOCl2+H2O=SO2+2HCl。实验室中制取无水氯化锌采用ZnCl2·xH2O与SOCl2混合加热的方法。试回答:
SOCl2的作用是___________________________________。
醋酸是重要的一元酸,在有机和无机反应中都有应用.现有25℃时pH=3的醋酸。请回答下列问题:
(1)若向醋酸中加入少量醋酸钠固体,此时溶液中c(H+)/c(CH3COOH)将
(填“增大”、“减小”或“不变”)。
(2) 若向醋酸中加入稀NaOH溶液,使其恰好完全反应,所得溶液的pH 7
(填“>”、“<”或“=”);用离子方程式表示其原因 。
(3)若向醋酸中加入稀NaOH溶液至溶液恰好呈中性,此时c(Na+)c(CH3COO-)(填“>”“<”“=”)。
(1)①常温下,pH=3的盐酸和pH=11的氢氧化钡等 体积混合,溶液的pH=。
②常温下pH=3的盐酸和pH=6的盐酸等体积混合,溶液的pH=。(lg2=0.3)
(2)在某温度下,H2O的离子积常数为1×10-13,则该温度下
①某溶液中的H+浓度为1×10-7mol/L,则该溶液呈性。
②0.01mol/LNaOH溶液的pH=。
③99mL pH=1的H2SO4溶液与101mL pH=12的KOH溶液混合后,溶液的pH=。