常用于除去高速公路冰雪的是“氯盐类”融雪剂,如NaCl、MgCl2等,请回答:
(1)“氯盐类”融雪剂主要成分的晶体类型为 ;
(2)冰比硫化氢熔点高的原因是 ,冰分子中氧原子的杂化轨道类型为 ;
(3)已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
| X |
578 |
1817 |
2745 |
11578 |
| Y |
738 |
1451 |
7733 |
10540 |
| Z |
496 |
4562 |
6912 |
9543 |
元素Y第一电离能大于X的原因是 ;
(4)融雪剂对环境危害很大,如和路基上的铁等金属形成原电池,加快路面破损。铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,KCN过量时沉淀溶解,生成黄血盐,结构如图。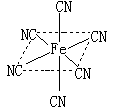
①写出铁元素基态原子价电子的轨道表示式 ;
②已知CN- 与 N2 结构相似,1 mol CN- 中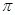 键数目为 ;
键数目为 ;
某澄清溶液,可能含有NH4+ 、Na+、K+、Cl-、CO32-、SO42-中的一种或几种,现做如下实验:
、Na+、K+、Cl-、CO32-、SO42-中的一种或几种,现做如下实验:
①取少量该溶液加入BaC l2溶液有白色沉淀生成,再加入足量盐酸后,沉淀部分溶解,并有气体生成。
l2溶液有白色沉淀生成,再加入足量盐酸后,沉淀部分溶解,并有气体生成。
②用铂丝蘸取少量该溶液置于无色酒精灯火焰中灼烧,火焰呈黄色,透过蓝色钴玻璃观察,未见紫色火焰。
③另取少量该溶液加入NaOH溶液并加热,将湿润的红色石蕊试纸靠近试管口无颜色变化。
(1)第①步可以检验出的离子是
(2)第②③步说明一定含有的离子是
(3)从以上操作中,不能判断是否存在的离子是 ,为了检验该离子是否存在,请你写出进一步检验的 操作步骤和实验现象:
操作步骤和实验现象:
有A、B、C、D、E五种元素,它们原子的核电荷数依次递增且均小于18;
A原子核内仅有1个质子;B原子的电子总数与C原子的最外层电子数相等; C原子有两个电子层,最外层电子数是次外层电子数的3倍;D元素的最外层电子数是其电子层数的三分之一。E的单质是黄绿色气体且有毒。
(1)写出A分别与B、C所形成化合物的化学式:,。
(2)分别写出C和D的原子结构示意图:,。
(3)写出C、D、E所形成的化合物的电离方程式:。
(4)写出E的单质与A、C、D三元素所形成的化合物反应的化学方程式,若是氧化还原反应,请用双线桥标出电子转移的数目和方向:。
同温同压下,若A容器中充满O2 ,B容器中充满O3。
(1)若所含分子总数相等,则A容器和B容器的容积之比是
(2)若两容器中所含原子总数相等,则A容器和B容器的容积比是
(3)若两容器的体积比为3∶2,则O2和O3物质的量之比为_________,质量之比为_______,密度之比为______________。
(3分)A元素的原子最外层有3个电子,B元素的原子最外层有7个电子,当它们失去或得到电子形成稳定结构时,A的化合价为________,B的化合价为____ _____,A与B结合形成化合物的化学式为_______________。
_____,A与B结合形成化合物的化学式为_______________。
已知:
(1)该反应的生成物中含有的官能团的名称是__________,该物质在一定条件下能发生_______(填序号)。
①氧化反应②还原反应③酯化反应
(2)已知HCHO分子中所有原子都在同一平面内,若要使R1CHO分子中所有原子可能都在同一平面内,R1可以是________(填序号)。
①—CH3②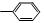 ③—CH═CH2
③—CH═CH2
(3)某氯代烃A的分子式为C6H11Cl,它可以发生如下转化:
结构分析表明E分子中含有两个甲基且没有支链。
①写出下列转化的反应类型:
A→B_______________;D→E_________________。
②A、E的结构简式分别为、
③写出A→B的化学方程式_________________