A、B、C、D、E、F、G七种前四周期元素,其原子序数依次增大。A的原子中没有成对电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D及其同主族元素的氢化物沸点变化趋势如图;F是地壳中含量最高的金属元素;G与F同主族。请回答下列问题:
(1)写出F元素基态原子的核外电子排布式 ;
(2)B、C、D三种元素电负性由大到小的顺序是 (用元素符号表示);
(3)下列有关上述元素的说法,正确的是 (填序号);
①CA3沸点高于BA4,主要是因为前者相对分子质量较大
②Ni(BD)4常温下为液态,易溶于CCl4、苯等有机溶剂,因此固态Ni(BD)4属于离子晶体
③C的氢化物的中心原子采取sp2杂化
④F单质的熔点高于E单质,是因为F单质的金属键较强
⑤比G的原子序数少1的元素第一电离能高于G
(4)CA3分子的空间构型为 ,1 mol B2A4分子中含有 molσ键;
(5)ED是优良的耐高温材料,其晶体结构与NaCl晶体相似。ED的熔点比NaCl高,其原因是 。
说明:O摄氏度=273K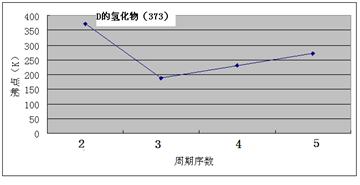
工业上用含锌物料(含FeO、CuO等杂质)可制得活性ZnO,流程如下: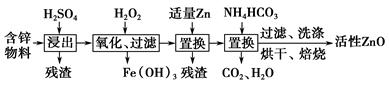
(1)上述流程中,浸出用的是60%H2SO4(1.5 g·cm-3),配制这种H2SO4 100 mL需要18.4 mol·L-1的浓H2SO4________ mL(保留一位小数)。
(2)加入氧化剂H2O2后,有Fe(OH)3沉淀出现,没有Cu(OH)2沉淀出现,若溶液中c(Fe3+)=2.6×10-18 mol·L-1,则溶液中c(Cu2+)的取值范围是________mol·L-1。(已知Ksp[Fe(OH)3]=2.6×10-39,
Ksp[Cu(OH)2]=2.2×10-20)
(3)加入NH4HCO3后生成的沉淀是形态均为Zna(OH)b(CO3)c(a、b、c为正整数)的两种碱式碳酸锌A和B的混合物,A中a=5、b=6,则生成碱式碳酸锌A的化学方程式为__________________________________________________。
(4)取洗涤、烘干后的碱式碳酸锌A和B的混合物49.70 g,其物质的量为0.10 mol,高温焙烧完全分解得到37.26 g ZnO、3.584 L CO2(标准状况下)和水,通过计算求出碱式碳酸锌B的化学式。
某同学购买了一瓶××牌“84消毒液”,查阅相关资料和消毒液包装说明得到如下信息:
“84消毒液”:含25%NaClO 1 000 mL、密度1.19 g·cm-3,稀释100倍(体积比)后使用。
请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为________ mol·L-1。
(2)该同学取100 mL该“84消毒液”稀释后用于消毒,稀释后的溶液中
c(Na+)=________ mol·L-1(假设稀释后溶液密度为1.0 g·cm-3)。
(3)某实验需用480 mL含25%NaClO的消毒液。该同学参阅该“84消毒液”的配方,欲用NaClO固体配制该消毒液。
①下列说法正确的是________。
A.如上图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制
C.利用购买的商品NaClO来配制可能导致结果偏低
D.需要称量的NaClO固体质量为143 g
②在配制过程中,下列操作可能使配制的溶液的浓度偏大的是________。
A.烧杯中溶液转移到容量瓶中时,未洗涤烧杯
B.定容时,俯视刻度线
C.定容时,仰视刻度线
D.移液时,有少量液体溅出
三氯化铁是一种很重要的铁盐,主要用于污水处理,具有效果好、价格便宜等优点。工业上可将铁屑溶于盐酸中,先生成FeCl2,再通入Cl2氧化来制备FeCl3溶液。
(1)将标准状况下的a L氯化氢气体溶于100 g水中,得到的盐酸的密度为
b g·mL-1,则该盐酸的物质的量的浓度是________。
向100 mL的FeBr2溶液中通入标准状况下Cl2 3.36 L,反应后的溶液中Cl-和Br-的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为 ________。
(3)FeCl3溶液可以用来净水,其净水的原理为____________________ _____________________(用离子方程式表示),若100mL 2mol·L-1的FeCl3溶液净水时,生成具有净水作用的微粒数________0.2NA(填“大于”、“等于”或“小于”)。
(1)在一定温度和压强下,1体积X2(g)和3体积Y2(g)化合生成2体积Z(g),则Z气体的化学式是________。
(2)在同温、同压下,实验测得CO、N2和O2三种气体的混合气体的密度是H2的14.5倍,其中O2的质量分数为________。若其中CO和N2的物质的量之比为1∶1,则混合气体中氧元素的质量分数为________。
(3)相同条件下,某Cl2与O2混合气体100 mL恰好与150 mL H2化合生成HCl和H2O,则混合气体中Cl2与O2的体积比为________,混合气体的平均相对分子质量为________。
(4)现有m g某气体,它的摩尔质量为M g·mol-1,则
①该气体溶于1 L水中(不考虑反应),其溶液中溶质的质量分数为________。
②该气体溶于水后形成V L溶液,其溶液的物质的量浓度为______ mol·L-1。
铜器久置于空气中会和空气中的水蒸气、CO2、O2作用产生“绿锈”,该“绿锈”俗称“铜绿”,化学式为Cu2(OH)2CO3,“铜绿”能跟酸反应生成铜盐和CO2、H2O。某同学利用下述系列反应实现了“铜→铜绿……→铜”的转化。
(1)从三种不同分类标准回答,“铜绿”属于哪类物质?
________、________、________。
(2)请写出铜绿与盐酸反应的化学方程式_________________________________。
(3)写出B的化学式________。
(4)上述转化过程中属于化合反应的是________,属于复分解反应的是________。
(5)胶体铜在电子行业、塑料和陶瓷电镀等方面应用广泛。下列关于溶液和胶体的叙述,正确的是________。
| A.一束光线分别通过溶液和胶体时,后者能看到一条光亮的“通路”,前者则没有 |
| B.溶液是电中性的,胶体是带电的 |
| C.溶液中溶质分子可以通过滤纸,胶体中分散质粒子则不能通过滤纸 |
| D.通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动 |