(6分)在NaCl、NaOH、Na2O2、O2、H2O2、HCl中。只含有离子键的是 ___,只含有极性键的是 ,只含有非极性键的是 ,既含有离子键又含有极性键的是 ,既含有离子键有含有非极性键的是 ,既含有极性键又含有非极性键的是____________。
(12分) 铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如图所示: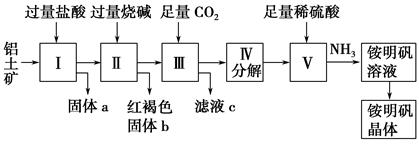
请回答下列问题:
(1)固体a的化学式为________,Ⅲ中通入足量CO2气体发生反应的离子方程式为_________________。
(2)由Ⅴ制取铵明矾溶液的化学方程式为。
从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)、冷却结晶、过滤洗涤。
(3)以1 000 kg含氧化铝36%的铝土矿为原料制取Al2(SO4)3,需消耗质量分数98%的硫酸(密度1.84 g·cm-1)L(计算结果请保留一位小数)。
(4)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1∶1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为。
(9分) 向浓度相等、体积均为50 mL的A、B两份KOH溶液中,分别通入一定量的SO2气体后,再稀释到100 mL。
(1)在KOH溶液中通入一定量的SO2气体后,溶液中溶质的组成可能是:
①;②;
③;④。
(2)在稀释后的溶液中逐滴加入0.1 mol/L的盐酸,产生SO2的体积(标准状况)与所加盐酸的体积关系如下图所示。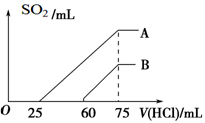
①A曲线表明,原溶液通入SO2气体后,所得溶质与盐酸反应产生SO2的最大体积是________mL(标准状况)。
②B曲线表明,原溶液通入SO2气体后,所得溶液中溶质的化学式为_________________。
③原KOH溶液的物质的量浓度为。
(9分) 在下列物质转化中,已知A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是酸;当X无论是强酸还是强碱时,都有如下的转化关系: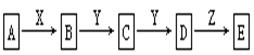
说明:当X是强酸时A、B、C、D、E均含同一种元素;当X是强碱时,A、B、C、D、E均含另外同一种元素。(已知H2CO3、H2S、H2SO3、H2SiO3皆为二元弱酸)
请回答下列问题:
(1)A是,Y是,Z是(填化学式,下同)。
(2)当X是强酸时,E是,写出B生成C的化学方程式: _____ 。
(3)当X是强碱时,E是,写出D生成E的离子方程式:。
(10分) 测得某金属冶炼厂的酸性工业废水中,含有一定量的Fe3+、Cu2+、Au3+等离子。按照“变废为宝”的原则,设计了下图中的回收流程,要求利用常见的酸、碱和工业生产中的废铁屑,从该工业废水中回收金、并生产化工原料铁红和氧化铜。
请你完成下面的问题:
(1)流程图中标号处需加入的相应物质分别是:①;②;
③;④;⑤。
(2)写出流程图中①处可能发生的所有反应的离子方程式: 。
(3)写出流程图中③处发生反应的化学方程式。
工业上通常用下列方法治理含氮化合物的污染。
(1)用稀土等催化剂能将汽车尾气中的CO、NOx、碳氢化合物转化成无毒物质,从而减少汽车尾气污染。已知:
①N2(g)+ O2(g)=2NO(g) △H=+180.5 kJ/mol ②2C(s)+ O2(g)=2CO(g) △H=—221.0 kJ/mol
③C(s)+ O2(g)=CO2(g) △H=—393. 5 kJ/mol
写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式。
(2)用NH3还原NOx生成N2和H2O。现有NO、NO2的混合气3 L,可用同温同压下3.5 L的NH3恰好使其完全转化为N2,则原混合气体中NO和NO2的物质的量之比为。
(3)电化学降解治理水中硝酸盐污染。在酸性条件下,电化学降解NO的原理如图1,A为电源的极,阴极反应式为。
(4)通过控制溶液的pH对工业废水中的金属离子进行分离。图2是某些金属氢氧化物在不同浓度和pH时的沉淀——溶解图像,图中直线上的点表示平衡状态。当溶液中的离子浓度小于1×10-5 mol·L-1时,认为该离子沉淀完全。
①Fe (OH)3、Al(OH)3、Cr(OH)3三种物质的溶度积常数最大的是,
图中A、B、C三点中表示Fe(OH)3的沉淀速率大于溶解速率的是。
②由图可得Fe(OH)2的溶度积的值为。