已知X、Y、Z、W是短周期中的四种非金属元素,它们的原子序数依次增大,X元素的原子形成的阳离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子 数的2倍。
数的2倍。 试回答:
试回答:
(1) 写出下列元素的元素符号:X_________、Y_________、Z_________、 W_________。
W_________。
(2 这四种元素可组成原子个数比为5∶1∶1∶3的化合物(按X、Y、Z、W的顺序),该化合物的水溶液与足量NaOH溶液反应的离子方程式为 。
(3) 将9g单质Y在足量W单质中燃烧,所得气体通入1L 1mol·L-1 NaOH溶液中,完全吸收后,将溶液在减压低温条件下蒸干,得到不含结晶水的固体质量为 g。
(1)除去亚铁离子中混有的铁离子用试剂______,离子方程式_______________________
(2)除去混在氯化钠(NaCl)中的少量氯化镁(MgCl2), 用_____________(试剂),离子方程式是___________________________
由等物质的量烃A和烃的衍生物B组成的混合物共0.5摩,恰好能和1.25摩O2完全燃烧生成1molCO2和1molH2O,请用分子式给出A和B的可能组合方式(可不填满)
| A |
B |
|
| (1) |
||
| (2) |
||
| (3) |
||
| (4) |
||
| (5) |
(12分)某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如下图。加热聚丙烯废塑料得到的产物如下表:
| 产物 |
氢气 |
甲烷 |
乙烯 |
丙烯 |
苯 |
甲苯 |
碳 |
| 质量分数(%) |
12 |
24 |
12 |
16 |
20 |
10 |
6 |
(1)试管A中残余物有多种用途,如下列转化就可制取高聚物聚乙炔。
写出反应②③的化学方程式:____________________、____________________。
(2)试管B收集到的产品中,能使高锰酸钾酸性溶液褪色的物质,其一氯代物有_____种。
(3)锥形瓶C中观察到的现象______________。
(4)写出C中逸出的气体在工业上的两种用途:________________、_______________。
课本的第27页介绍了一种热带雌蚕蛾为了吸引同类雄蛾会分泌出叫“蚕蛾醇”的物质。蚕蛾醇有多种顺反异构体,如
请回答:
(1)蚕蛾醇共有多少种顺反异构体(含自身)。
(2)该蚕蛾醇手性碳原子数为。
(3)该蚕蛾醇的分子式为。
(4)该蚕蛾醇不具有的性质是(从下面序列中选择序号填入)
①酯化②氧化③加聚④加成⑤NaOH中和反应
(1)某合成物的结构简式为 ,则合成它的单体为_____________________________________。
,则合成它的单体为_____________________________________。
(2)烯烃在一定条件下被氧化时,由于碳碳双键断裂,转化为醛或酮,如: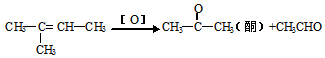
若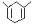 在发生上述反应时其产物的结构产物为______________________
在发生上述反应时其产物的结构产物为______________________
(3)写出苯与液溴在FeBr3催化下制溴苯的化学反应方程式: