某铜矿石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以此铜矿石为原料制备CuSO4·5H2O 及CaCO3,部分步骤如下:
请回答下列问题:
(1)溶液A除含有Cu2+外,还可能含有的金属离子有________(填离子符号),验证所含离子所用的试剂是______________。
(2)可用生成的CO2制取优质碳酸钙。制备时,先向氯化钙溶液中通入氨气,再通入CO2。
①实验室通常采用加热氯化铵和氢氧化钙混合物的方法制取氨气。某学习小组选取下图所给部分装置制取并收集纯净的氨气。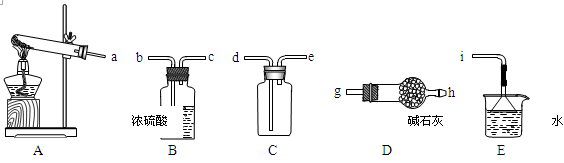
如果按气流方向连接各仪器接口,你认为正确的顺序为a→______、______→______、______→ i。其中与i相连漏斗的作用是______________。
②实验室中还可用固体氢氧化钠和浓氨水制取少量氨气,下列最适合完成该实验的简易装置是_________(填编号)
(3)测定铜矿石中Cu2(OH)2CO3质量百分含量的方法是:a.将1.25g铜矿石制取的CuSO4·5H2O于锥形瓶中,加入适量水完全溶解;b.向溶液中加入100mL0.25mol/L的氢氧化钠溶液使Cu2+完全沉淀;c.过滤;d.滤液中的氢氧化钠溶液用0.5mol/L盐酸滴定至终点,耗用10mL盐酸。则铜矿石中Cu2(OH)2CO3质量分数为_____________。
(12 分)CH3COOH是中学化学中常用的一元弱酸,请回答下列问题:
(1)若分别将pH=2的盐酸和醋酸稀释100倍,则稀释后溶液的pH:盐酸 醋酸(填“>”、“=”或“<”)。
(2)将100mL 0.1mol·L-1的CH3COOH溶液与50mL 0.2mol·L-1的NaOH溶液混合,所得溶液呈 性,原因 (用离子方程式表示)。
(3)已知某混合溶液中只含有CH3COO-、H+、Na+、OH-四种离子,且离子浓度大小关系为:c(CH3COO-)> c(H+)> c(Na+)> c(OH-),则该溶液中含有的溶质为 。
(4)已知Ka(CH3COOH)= 1.76×10-5,Ka(HNO2)= 4.6×10-4,若用同浓度的NaOH溶液分别中和等体积且pH相等的CH3COOH和HNO2,则消耗NaOH溶液的体积关系为:
前者 后者(填“>,<或=”)
(5)已知25℃时,0.1mol·L-1醋酸溶液的pH约为3,向其中加入少量醋酸钠晶体,发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠呈碱性,所以溶液的pH增大;乙同学给出另外一种不同于甲同学的解释,请你写出乙同学可能的理由
碘钨灯具有使用寿命长、节能环保等优点。一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:
W(s)+I2(g) WI2(g)ΔH<0
WI2(g)ΔH<0
为模拟上述反应,在450℃时向一体积为2L的恒容密闭容器中加入0.1mol碘单质和足量的钨,2min后反应达到平衡,测得碘蒸气浓度为0.005 mol·L-1。请回答下列问题:
(1)前两分钟内碘蒸气的反应速率为 。
(2)能够说明上述反应已经达到平衡状态的有 。
| A.I2与WI2的浓度相等 |
| B.容器内气体压强不再变化 |
| C.W的质量不再变化 |
| D.单位时间内,金属钨消耗的物质的量与碘化钨生成的物质的量相等 |
E.容器内混合气体的密度保持不变
(3)下图为该反应在450℃时的时间—速率图,则t2时刻改变的外界条件可能是 ,若t4时刻将容器压缩至一半(各物质状态不变),保持该条件至t6,请在图中画出t4到t6时间段内大致曲线图,并在相应曲线上标上υ3(正)、υ3(逆)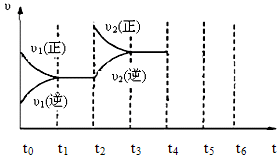
(6分)
某烯烃,经与氢气加成反应可得到结构简式为 的烷烃,则此烯烃可能的结构简式是: 、 、 。
的烷烃,则此烯烃可能的结构简式是: 、 、 。
写出下列化合物的名称或结构简式:
(1)结构简式为 此烃名称为 。
此烃名称为 。
(2)结构简式为 的烃可命名为 。
的烃可命名为 。
(3)2,5-二甲基-2,4-己二烯 的结构简式: 。
(4)结构简式为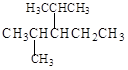 的烃可命名为: 。
的烃可命名为: 。
(4分)有下列几组物质,请将序号填入下列空格内:
| A.CH2=CH-COOH和油酸(C17H33COOH) |
| B.C60和石墨 |
C. 和 和 |
| D.35Cl和37Cl |
E.乙醇和乙二醇
①互为同位素的是 ;②互为同系物的是 ;
③互为同素异形体的是 ;④互为同分异构体的是 ;