一定温度范围内用氯化钠熔浸钾长石(主要成份为KAlSi3O8)可制得氯化钾,主要反应是:NaCl(l)+KAlSi3O8(s) KCl(l)+NaAlSi3O8(s)。
KCl(l)+NaAlSi3O8(s)。
(1)氯化钠的电子式是 。
(2)上述反应涉及的元素中,原子半径最大的是 。
(3)上述反应涉及的位于同一周期的几种元素中,有一种元素的最高价氧化物的水化物和其余元素的最价氧化物的水化物均能发生反应,该元素是 。
(4)某兴趣小组为研究上述反应中钾元素的熔出率(液体中钾元素的质量占样品质量的百分率)与温度的关系,进行实验(保持其它条件不变),获得如下数据:
| 时间(h) 熔出率 温度 |
1.5 |
2.5 |
3.0 |
3.5 |
4.0 |
5.0 |
| 800℃ |
0.054 |
0.091 |
0.127 |
0.149 |
0.165 |
0.183 |
| 830℃ |
0.481 |
0.575 |
0.626 |
0.669 |
0.685 |
0.687 |
| 860℃ |
0.515 |
0.624 |
0.671 |
0.690 |
0.689 |
0.690 |
| 950℃ |
0.669 |
0.714 |
0.710 |
0.714 |
0.714 |
―― |
①分析数据可以得出,氯化钠熔浸钾长石是 (填“放热”或“吸热”)反应。
②950℃时,欲提高熔出钾的速率可以采取的措施是 (填序号)。
a.充分搅拌
b.延长反应时间
c.增大反应体系的压强
d.将钾长石粉粹成更小的颗粒
(5)该方法制得KCl提纯后可用来冶炼金属钾。反应Na(l)+KCl(l) NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,用平衡原理解释该方法可行的原因是 。
NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,用平衡原理解释该方法可行的原因是 。
(14分)下图所示为血红蛋白和肌红蛋白的活性部分――血红素的结构式。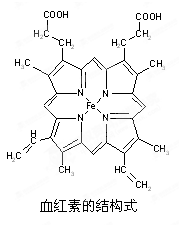
回答下列问题:
⑴血红素中含有C、H、O、N、Fe五种元素,C、N、O三种元素的第一电离能由小到大的顺序是_______________,写出基态Fe原子的核外电子排布式_________________。
⑵血红素中N原子的杂化方式分别为________、________,在右图的方框内用“→”标出Fe2+的配位键。
⑶铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为_________,δ、α两种晶胞中铁原子的配位数之比为____________。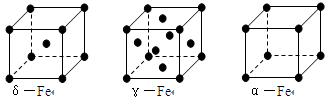
(12分)我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。高炉内可能发生如下反应:
C(s)+O2(g) = CO2(g)△H1=-393.5 kJ·mol—1 ①
C(s)+CO2(g) = 2CO(g)△H2=+172.5 kJ·mol—1②
4CO(g )+Fe3O4(s) = 4CO2(g)+3Fe(s)△H3=-13.7 kJ·mol—1 ③
)+Fe3O4(s) = 4CO2(g)+3Fe(s)△H3=-13.7 kJ·mol—1 ③
请回答下列问题:
⑴计算3Fe(s)+2O2(g) = Fe3O4(s)的△H=___________________。
⑵8 00℃时,C(s)+CO2(g)
00℃时,C(s)+CO2(g) 2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此时反应向_______(填“正”或“逆”)方向进行。
2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此时反应向_______(填“正”或“逆”)方向进行。
⑶某种矿石中铁元素以氧化物FemOn形式存在,现进行如下实验:将少量铁矿石样品粉碎,称取25.0 g样品于烧杯中,加入稀硫酸充分溶解,并不断加热、搅拌,滤去不溶物。向所得滤液中加入10.0 g铜粉充分反应后过滤、洗涤、干燥得剩余固体3.6 g。剩下滤液用浓度为2 mol·L-1的酸性KMnO4滴定,至终点时消耗KMnO4溶液体积25.0 mL。
提示:2Fe3++Cu=2Fe2++Cu2+ 8H++MnO4-+5Fe2+=Mn2++5Fe3++4H2O
①计算该铁矿石中铁元素的质量分数。(请写出必要的解题步骤)
②计算氧化物FemOn的化学式(m、n为正整数)(请写出必要的解题步骤)
(12分)以硫铁矿为原料生产硫酸所得的酸性废水中砷元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,相关数据如下表。
| 难溶物 |
Ksp |
| Ca3(AsO4)2 |
6.8×10-19 |
| AlAsO4 |
1.6×10-16 |
| FeAsO4 |
5.7×10-21 |
表1.几种砷酸盐的Ksp
| 污染物 |
H2SO4 |
As |
| 浓度 |
28.42 g/L |
1.6 g·L-1 |
| 排放标准 |
pH 6~9 |
0.5 mg·L-1 |
表2.工厂污染物排放浓度及允许排放标准
回答以下问题:
⑴该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)=______________mol·L-1。
⑵写出难溶物Ca3(AsO4)2的Ksp表达式:Ksp[Ca3(AsO4)2]=______________,若混合溶液
中Al3+、Fe3+的浓度均为1.0×10-4mol·L-1,c(AsO43-)的最大是_______________mol·L-1。
⑶工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),写出该反应的离子方程式________________________________。
⑷在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH
调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为______________;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀的原因为_____________________________。
(15分)尿素(H2NCONH2)是一种非常重要的高氮化肥,工业上合成尿素的反应如下:
2NH3(l)+CO2(g) 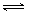 H2O(l)+H2NCONH2 (l) △H=-103.7 kJ·mol-1
H2O(l)+H2NCONH2 (l) △H=-103.7 kJ·mol-1
试回答下列问题:
⑴下列措施中有利于提高尿素的产率的是___________。
A.采用高温
B.采用高压
C.寻找更高效的催化剂
⑵合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g) 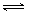 H2NCOONH4(氨基甲酸铵) (l)△H1
H2NCOONH4(氨基甲酸铵) (l)△H1
第二步:H2NCOONH4(l) 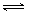 H2O(l)+H2NCONH2(l)△H2
H2O(l)+H2NCONH2(l)△H2
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下图Ⅰ所示:
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第_____步反应决定,总反应进行到_________min时到达平衡。
②反应进行到10 min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)=_______________________。
③第二步反应的平衡常数K随温度的变化如上右图Ⅱ所示,则△H2__________0(填“>”“<”或“=”)
(15分)我国是氧化铝生产大国,工业上每生产1 t氧化铝将排出1~2 t赤泥,赤泥大量堆积会对环境造成严重污染。赤泥中主要成分及含量:CaO约占46%、SiO2约占22%、Al2O3约占7%、Fe2O3约占11%、TiO2约占5%及少量其他物质。
⑴一种利用废弃赤泥的方法是将赤泥配成一定的液固比,作为一种吸收剂,吸收热电厂排放的含SO2的烟气,写出吸收SO2时可能发生的化学反应方程式______________________。
⑵为综合利用赤泥中的各种成分,某科研小组设计了如下工艺流程:
已知:TiO2不溶于稀盐酸、稀硫酸,能溶于浓硫酸生成TiOSO4(硫酸氧钛,易水解)。
①氧化物D的化学式是_____________,原料A最好是下列物质中的____________。
| A.氨水 | B.氢氧化钠 | C.生石灰 | D.双氧水 |
②写出上述工艺中投入氢氧化钠时反应的离子方程式:
______________________________________________________。
③写出上述工艺中稀释时发生水解反应的化学方程式:
______________________________________________________。