(1)(4分)某化学反应,设反应物总能量为E1,生成物总能量为E2。若E1>E2,则该反应为______热反应,该反应的能量转化是_________________________。
(2)用锌片、铜片和稀盐酸组成的原电池,正极的电极反应是___________________,负极的电极反应是_______________________,原电池的总反应是_________________ ___。
(8分)有一包白色固体,可能含有CaCO3、Na2SO4、KNO3、CuSO4、BaCl2五种物质中的一种或几种。现进行如下实验:
①取少量固体粉末,加入盛有足量水的烧杯中,充分搅拌静置后,底部白色沉淀,上层为无色溶液;
②继续往烧杯中加入足量稀硝酸,白色沉淀完全消失;并有气泡产生。
③取少量②中溶液滴加Ba(NO3)2溶液,有白色沉淀生成,再加入稀硝酸,沉淀不溶解。
(1)根据以上实验现象可知,该白色固体中一定含有 ,(填化学式,下同)一定不含有 ,可能含有 。
(2)上述实验②过程中所发生反应的离子方程式为:
(10分)现有14.4 g CO和CO2的混合气体,在标准状况下其体积为8.96 L。回答下列问题:
(1)该混合气体的平均摩尔质量为___________。
(2)混合气体中碳原子的个数为__________(用NA表示阿伏加德罗常数的值)。
(3)将混合气体依次通过下列如图所示装置,最后收集在气球中(实验在标准状况下测定)。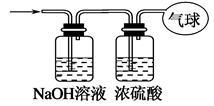
①气球中收集到的气体的摩尔质量为___________。
②气球中收集到的气体中,电子总数为___________(用NA表示阿伏加德罗常数的值)。
③气球的体积为_________L。
(4分)今有11种物质:①铝线;②石墨;③氯气;④BaSO4晶体;⑤纯硫酸;⑥金刚石;⑦石灰水;⑧乙醇;⑨熔融的KNO3;⑩NH3;⑪盐酸。其中:
(1)能导电的是(填序号,下同)____________________________;
(2)属于电解质的是___________________________________;
(3)属于非电解质的是_______________________________;
(4)既不是电解质又不是非电解质的是_____________________。
研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)已知石墨的标准燃烧热为y kJ·mol-1,1.2g石墨在1.68L(标准状况)氧气中燃烧,至反应物耗尽,放出x kJ热量,则石墨与氧气反应生成CO的热化学方程式为________________。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H
CH3OH(g)+H2O(g) △H
①该反应的平衡常数表达式为K=______________________。
②取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇反应的ΔH_______________(填“>” “<”或“=”)0。
③在两种不同温度下发生反应,测得CH3OH的物质的量随时间变化如图3所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ ____________KⅡ(填“>” “<”或“=”)。
④一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡。
| 容器 |
甲 |
乙 |
| 反应物 投入量 |
1molCO2 3molH2 |
a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) (a、b、c均不等于0) |
若甲中平衡后气体的压强为开始时的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为________________。
过氧化氢和臭氧都是常见的绿色氧化剂,工业生产中有着重要用途。
(1)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂。
已知:N2H4(l)+O2(g)===N2(g)+2H2O(g),ΔH=-534 kJ·mol-1
H2O2(l)===H2O(l)+ O2(g),ΔH=-98 kJ·mol-1
O2(g),ΔH=-98 kJ·mol-1
H2O(l)===H2O(g),ΔH=+44 kJ·mol-1
试写出N2H4和液态H2O2反应生成气态水的热化学方程式_________________________。
(2)新型O3氧化技术对燃煤烟气中的NOx和SO2脱除效果显著,锅炉烟气中的NOx 95%以上是以NO形式存在的,可发生反应NO(g)+O3(g) NO2(g)+O2(g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应,正反应速率随时间变化的示意图如图所示。由图可得出的正确说法是________________。
NO2(g)+O2(g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应,正反应速率随时间变化的示意图如图所示。由图可得出的正确说法是________________。
a.反应在c点达到平衡状态
b.反应物浓度:b点小于c点
c.该反应为放热反应
d.Δt1=Δt2时,NO的转化量:a~b段小于b~c段