科学家一直致力于“人工固氮”的方法研究。
⑴目前合成氨的技术原理为:
该反应的能量变化如图所示。
①在反应体系中加入催化剂,反应速率增大,E2的变化是: 。(填“增大”、“减小”或“不变”)。
②将一定量的N2(g)和H2(g)放入1L的密闭容器中,在500℃、2×107Pa下达到平衡,测得N2为0.1 mol,H2为0.3 mol,NH3为0.1 mol。该条件下H2的转化率为 。
③欲提高②容器中H2的转化率,下列措施可行的是 。
| A.向容器中按原比例再充入原料气 |
| B.向容器中再充入惰性气体 |
| C.改变反应的催化剂 |
| D.液化生成物分离出氨 |
⑵1998年希腊亚里士多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传导H+),从而实现了高转化率的电解法合成氨。其实验装置如图所示。阴极的电极反应式为 。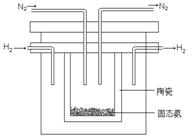
⑶根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生下列反应:
进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
| T/K |
303 |
313 |
323 |
| NH3生成量/(10-6mol) |
4.8 |
5.9 |
6.0 |
①此合成反应的a_ 0。(填“大于”、“小于”或“等于”)
②已知
⑷ NH4Cl溶液呈酸性,这是由于NH 水解的缘故。则NH4Cl在重水(D2O)中水解的离子方程式是 。
水解的缘故。则NH4Cl在重水(D2O)中水解的离子方程式是 。
根据要求完成下列各小题
(1)①实验室用加热固体混合物的方法制备氨气的化学反应方程式是。
②为了得到干燥的NH3,用________做干燥剂。(填编号)
| A.碱石灰 | B.浓H2SO4 | C.无水CaCl2 | D.P2O5 |
(2)H2O参与的置换反应:
符合X+W→Y+V,已知X和Y分别是短周期同主族两种元素形成的单质, W、V是化合物
①W是水且V的焰色反应为黄色,离子方程式 ;
②V是水,化学方程式为 。
一定条件下, Ni2+与丁二酮肟生成鲜红色沉淀A。
(1)基态Ni2+的核外电子排布式为。
(2)丁二酮肟组成元素中C、N、O的电负性由大到小的顺序为。丁二酮肟分子中C原子轨道的杂化类型是。
(3)元素Ni的一种碲(Te)化物晶体的晶胞结构如图所示,则该化合物的化学式为。
(4)Ni(CO)4是一种无色液体,沸点为42.1℃,熔点为-19.3℃。Ni(CO)4的晶体类型是。请写出一种由第二周期主族元素组成的且与CO互为等电子体的阴离子的电子式。
二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
① CO(g)+2H2(g) CH3OH(g)△H 1=-90.7 kJ·mol-1
CH3OH(g)△H 1=-90.7 kJ·mol-1
② 2CH3OH(g) CH3OCH3(g)+H2O(g)△H 2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g)△H 2=-23.5 kJ·mol-1
③ CO(g)+H2O(g) CO2(g)+H2(g)△H 3=-41.2kJ·mol-1
CO2(g)+H2(g)△H 3=-41.2kJ·mol-1
回答下列问题:
(1)则反应3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的△H=kJ·mol-1。
CH3OCH3(g)+CO2(g)的△H=kJ·mol-1。
(2)下列措施中,能提高CH3OCH3产率的有。
A.使用过量的CO B.升高温度 C.增大压强
(3)反应③能提高CH3OCH3的产率,原因是。
(4)将合成气以n(H2)/n(CO)=2通入1 L的反应器中,一定条件下发生反应:
4H2(g)+2CO(g)  CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是。
CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是。
A.△H <0
B.P1<P2<P3
C.若在P3和316℃时,起始时n(H2)/n(CO)=3,则达到平衡时,CO转化率小于50%[
(5)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚。观察图2回答问题。催化剂中n(Mn)/n(Cu)约为时最有利于二甲醚的合成。
(6)图3为绿色电源“二甲醚燃料电池”的工作原理示意图,a电极的电极反应式为。
图1图2图3
(7)甲醇液相脱水法制二甲醚的原理是:CH3OH +H2SO4→CH3HSO4+H2O,
CH3 HSO4+CH3OH→CH3OCH3+H2SO4。与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是。
由软锰矿制备高锰酸钾的主要反应如下:
熔融氧化 3MnO2+KClO3+6KOH 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
加酸歧化 3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度(293K)见下表:
| K2CO3 |
KHCO3 |
K2SO4 |
KMnO4 |
|
| 溶解度/g |
111 |
33.7 |
11.1 |
6.34 |
(1)在实验室进行“熔融氧化”操作时,应选用铁棒、坩埚钳和。(填字母)
a.表面皿 b.蒸发皿 c.铁坩埚 d.泥三角
(2)加酸时不宜用硫酸的原因是;不宜用盐酸的原因是。
(3)采用电解法也可以实现K2MnO4的转化,2K2MnO4+2H2O 2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为。
2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为。
(4)草酸钠滴定法分析高锰酸钾纯度步骤如下:
Ⅰ 称取0.80 g左右的高锰酸钾产品,配成50 mL溶液。
Ⅱ 准确称取0.2014 g左右已烘干的Na2C2O4,置于锥形瓶中,加入少量蒸馏水使其溶解,再加入少量硫酸酸化。
Ⅲ 将瓶中溶液加热到75~80 ℃,趁热用Ⅰ中配制的高锰酸钾溶液滴定至终点。记录消耗高锰酸钾溶液的体积,计算得出产品纯度。
①滴定过程中反应的离子方程式为。
②达到滴定终点的标志为。
③加热温度大于90℃,部分草酸发生分解,会导致测得产品纯度。(填“偏高”、“偏低”或“无影响”)
④将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如图,其原因可能为。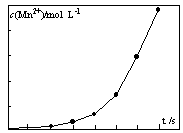
以粗氧化锌粉(含FeO、Fe2O3、ZnS等)制取活性ZnO的工艺如下:
步骤1:以H2SO4浸出粗氧化锌,同时加入H2O2;
步骤2:过滤,调节滤液的pH;
步骤3:过滤,向滤液中加NH4HCO3,得碱式碳酸锌沉淀;
步骤4:过滤、洗涤、煅烧,得产品。
已知:离子沉淀的pH见下表。
| 离子 |
开始沉淀pH |
沉淀完全pH |
| Fe2+ |
7.6 |
9.6 |
| Fe3+ |
2.7 |
3.7 |
| Zn2+ |
5.4 |
8.0 |
(1)加入H2O2时能浸出硫化锌,同时生成淡黄色固体,写出其化学方程式。
(2)步骤2中调节溶液pH的范围是 。
(3)取洗涤、干燥后的碱式碳酸锌68.2 g,充分灼烧后测得残留物质的质量为48.6 g,将所得气体通入足量澄清石灰水中,得沉淀20 g。计算碱式碳酸锌的组成(用化学式表示,写出计算过程)。