根据要求完成下列各小题
(1)①实验室用加热固体混合物的方法制备氨气的化学反应方程式是 。
②为了得到干燥的NH3,用________做干燥剂。(填编号)
| A.碱石灰 | B.浓H2SO4 | C.无水CaCl2 | D.P2O5 |
(2)H2O参与的置换反应:
符合X+W→Y+V,已知X和Y分别是短周期同主族两种元素形成的单质, W、V是化合物
①W是水且V的焰色反应为黄色,离子方程式 ;
②V是水,化学方程式为 。
绿矾(FeSO4·7H2O)硫酸法生产一种稀有金属产品过程中产出的副产品,产品外观为淡绿色或淡黄绿色结晶固体。加入适量可调节碱性水中的pH,与水中悬浮物有机结合,并加速沉淀,主要应用于水质净化和工业废水处理,同时具有杀菌作用。
(1)98% 1.84 g/cm3的浓硫酸在稀释过程中,密度下降,当稀释至50%时,密度为1.4g/cm3,50%的硫酸物质的量浓度为(保留两位小数),50%的硫酸与30%的硫酸等体积混合,混合酸的浓度为(填>、<、=")40%" 。
(2)实际生产用20%发烟硫酸(100克发烟硫酸含SO3 20克)配制稀硫酸,若用SO3·nH2O表示20%的发烟硫酸,则n=____________(保留两位小数)。
(3)绿矾在空气中容易被部分氧化为硫酸铁,现取7.32克晶体溶于稀盐酸后,加入足量的BaCl2溶液,过滤得沉淀9.32克;再通入112mL(标准状况)氯气恰好将Fe2+完全氧化,推测晶体的化学式为。
(4)硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐),较绿矾稳定,在分析化学中常用来配制Fe2+的标准溶液,用此Fe2+的标准溶液可以测定剩余稀硝酸的量。现取8.64克Cu2S和CuS的混合物用200 mL 2 mol/L稀硝酸溶液处理,发生反应如下:
10NO3-+3Cu2S+16H+=6Cu2++10NO↑+3SO42-+8H2O
8NO3-+3CuS+8H+=3Cu2++3 SO42-+8NO↑+ 4H2O
剩余的稀硝酸恰好与V mL 2 mol/L (NH4)2Fe(SO4)2溶液完全反应。
已知:NO3-+3Fe2++4H+= NO↑+3Fe3++2H2O
①V值范围;
②若V=48,试计算混合物中CuS的质量分数(保留两位小数)。
已知:Pb的化合价只有+2、+4,且+4价的Pb具有强氧化性,能氧化浓HCl生成Cl2;PbO2不稳定,随温度升高按下列顺序逐步分解:
PbO2→Pb2O3→Pb3O4→PbO。
现将amol PbO2加热分解,收集产生的O2;向加热后所得固体中加入足量的浓盐酸,收集产生的Cl2。加热反应后所得固体中,Pb2+占Pb元素的物质的量分数为x;两步反应中收集的O2和Cl2的物质的量之和为y mol。
试回答下列问题:
⑴试写出Pb2O3与浓盐酸反应的化学方程式__________________________
⑵通过计算确定y与a、x的函数关系式____________________
⑶若两步反应中O2和Cl2的物质的量之比为5∶3,则剩余固体中含有的物质为____;其物质的量之比为________________。
下面的表格是元素周期表的一部分,其中的字母对应不同的元素。
请回答下列问题:
(1)G和J形成的合金是一种贮氢材料,其晶体结构与氯化铯相同。该合金中每个G原子周围与其最近且等距的J原子有个。该晶体属于晶体
| A.离子晶体 | B.原子晶体 | C.分子晶体 | D.金属晶体 |
(2)M3R2是一种直线型分子R=M=M=M=R,该分子是一种分子(填极性或非极性)。
(3)请写出D-的电子排布式:。
(4)M2A2也是直线型分子,1个分子中含有个σ键。
(5)化合物E2D6分子中各原子均达到了八电子稳定结构,请画出其结构式。(用元素符号表示)
(1)现有下列四种物质:①AlCl3 ②NH3 ③NaHCO3 ④SiO2。
为石英主要成分的是(填序号,下同),能进行喷泉实验,极易溶于水的气体是,向其溶液中,逐滴加入氢氧化钠溶液,先产生白色沉淀,后沉淀溶解的是,俗称为“小苏打”的是。
(2)483克Na2SO4·10H2O所含的Na+的物质的量是,SO42-的物质的量是。
人体内的铁不是以单质的形式存在,而是以Fe2+和Fe3+的形式存在。正二价铁离子易被吸收,给人补充所需铁元素时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可将食物中的Fe3+转变成Fe2+,有利于人体吸收。
(1)在人体中进行下列转化时 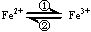 ,②中的Fe3+作剂。
,②中的Fe3+作剂。
(2)“服用维生素C,可将食物中的Fe3+转化成Fe2+ ”这句话指出,维生素C在这一反应中作剂,
具有性;某同学欲通过实验探究维生素C的这种性质,可选择的试剂是(填字母)。
a.KI溶液 b.碘水、淀粉 c.酸性高锰酸钾溶液