钢铁工业已成为我国重要的支柱产业。某大型铁矿附近有炼焦煤、石灰石、黏土矿和丰富的水资源。
(1)随着铁矿的开发,该地建立了如图所示位置关系的炼焦厂、钢铁厂、发电厂和水泥厂。请写出图中B、D所代表的两个工厂的名称:B.__________;D.__________。
(2)硫铁矿其外观如黄金,故又被称为“愚人金”。现有黄金、愚人金两种小块试样,提供的仪器主要有:
A.托盘天平 B.酒精喷灯
C.试管夹 D.坩埚钳
E.烧杯 F.量筒
另外,H2O、空气可任意选用,请回答问题:
若用物理方法来鉴别该黄金、愚人金试样,应选用的仪器为__________(填代号);
②若用化学方法来鉴别该黄金、愚人金试样,应选用的仪器为__________(填代号)。
(3)煤炭燃烧排放的烟囱气中含有NOx和SO2。含有碱的黄磷乳浊液能够同时去除NOx和SO2,这是由美国科学家研发的,命名为PhoSNOx法。在该方法的最后阶段NO2-与HSO3-反应生成(NH4)2SO4,其离子方程式为________________________。
Ⅰ.铁是一种过渡元素,金属铁是最常用的金属之一。请回答下列问题:
(1)生铁中含有一种铁碳化合物(Fe3C),在足量的空气中高温煅烧,生成有磁性的固体和能使澄清石灰水变浑浊的气体,该反应的化学方程式为,上述反应生成的磁性固体与过量浓硝酸反应后的溶液中含有的盐的化学式为。
(2)硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾。利用烧渣制绿矾的过程如下: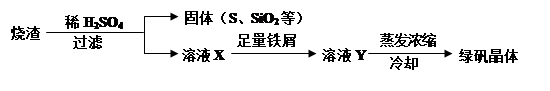
①烧渣溶于稀H2SO4过程中,有单质硫生成,写出该反应的离子方程式(只写生成S的反应式,其他反应无需写出)。
②向溶液X中加入足量铁屑的目的是。
(3)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36。室温时向FeCl3溶液中滴加NaOH溶液,当溶液pH=3时,通过计算说明Fe3+是否沉淀完全)
(提示:当某离子浓度小于10-5mol•L-1时可以认为该离子沉淀完全了)。
Ⅱ.(1)某溶液中有Mg2+、Fe3+、Al3+、Cu2+等离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入到过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的金属阳离子是________;用离子方程式解释其原因_________________。
(2)在25℃下,向浓度均为0.01 mol・L-1的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式______________(已知25℃时Ksp[Mg(OH)2]=1.8×10-11 Ksp[Al(OH)3]="3×10" -34)。
(3)将Mg、Cu组成的1.96g混合物投入过量稀硝酸中,充分反应后,固体完全溶解时收集到还原产物NO气体0.896L(标准状况),向反应后的溶液中加入2mol/L的NaOH溶液80mL时金属离子恰好完全沉淀。则形成沉淀的质量为g。
铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正极、负极,并写出电极反应。
正极反应 ;
负极反应 。
某兴趣小组为了提高电池的效率,设计了下图所示的原电池。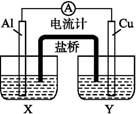
请回答下列问题:
(1)若X是AlCl3溶液,Y是稀硫酸,请你写出电极名称及电极反应:
Al片( ) , Cu片( ) 。
(2)若X是浓硝酸,Y是NaCl溶液,请你写出电极名称及电极反应:
Al片( ) , Cu片( ) 。
A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸,如下图所示: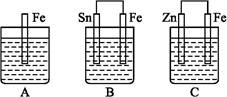
(1)A中反应的离子方程式为 。
(2)B中Sn极的电极反应式为 ,Sn极附近溶液的pH (填“升高”“降低”或“不变”)。
(3)C中被氧化的金属是 ,总反应式为 。
在容积不变的密闭容器中,分别充入1.0 mol N2和3.0 mol H2,在不同温度下,任其发生反应:N2(g)+3H2(g) 2NH3(g)。分别在同一时刻,不同温度下测定NH3的含量,然后绘制出如下图所示的曲线。
2NH3(g)。分别在同一时刻,不同温度下测定NH3的含量,然后绘制出如下图所示的曲线。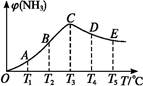
请回答下列问题:
(1)A、B、C、D、E五点中,尚未达到平衡状态的是 。
(2)此可逆反应的正反应是 (填“放热”或“吸热”)反应。
(3)AC段的曲线是增函数,CE段的曲线是减函数,试从反应速率和化学平衡的角度说明理由: 。