一定条件下, Ni2+与丁二酮肟生成鲜红色沉淀A。
(1)基态Ni2+的核外电子排布式为 。
(2)丁二酮肟组成元素中C、N、O的电负性由大到小的顺序为 。丁二酮肟分子中C原子轨道的杂化类型是 。
(3)元素Ni的一种碲(Te)化物晶体的晶胞结构如图所示,则该化合物的化学式为 。
(4)Ni(CO)4是一种无色液体,沸点为42.1℃,熔点为-19.3℃。Ni(CO)4的晶体类型是 。请写出一种由第二周期主族元素组成的且与CO互为等电子体的阴离子的电子式 。
已知25℃、101kpa时,一些物质的燃烧热为:
| 化学式 |
CO(g) |
H2(g) |
CH3OH(l) |
CH4(g) |
| △H/(kJ/mol) |
-283.0 |
-285.8 |
-726.5 |
-890.3 |
请回答下列问题。
(1)写出该条件下CH3OH(l)完全燃烧的热化学方程式:。
(2)根据盖斯定律完成下列反应的热化学方程式:CO(g)+ 2H2(g)= CH3OH(l);△H=。
(3)现有H2和CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2(g)和H2O(l),共放出热量3242.5 kJ,则原混合气体中H2和CH4的物质的量之比是:
| A.1∶1 | B.1∶3 | C.1∶4 | D.2∶3 |
氨气是氮循环中的重要物质,在人类的生产和生活中有着广泛的应用。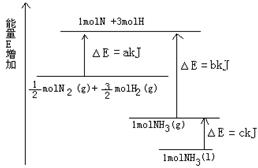
(1)上图是N2与H2反应过程中能量变化的示意图,则该反应生成液态氨的热化学方程式是______________________。
(2).若由N2和H2合成1molNH3时可放出46.2kJ/mol的热量。从手册上查出N≡N键的键能是948.9kJ/mol,H-H键的键能是436. 0kJ/mol,则N-H键的键能是________ kJ/mol。
分子式为C2H6O的化合物A具有如下性质:
(1)根据上述信息,对该化合物可作出的判断是。
| A.一定含有—OH | B.一定含有—COOH | C.A为乙醇 | D.A为乙酸(2)含A的体积分数为75%的水溶液可以用作。 |
(3)A与钠反应的化学方程式:。
(4)A可由含淀粉[(C6H10O5)n]的农产品如玉米、小麦、薯类等经发酵、蒸馏而得。请写出由淀粉制A的化学方程式:。
A、B、C、D四种元素,A元素所处的周期数,主族序数,原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C
(1)B元素的名称,________B在周期表中的位置_________________________,
(2)A、B形成的化合物的电子式________;
(3)C的元素符号________,C的最高价氧化物的化学式________;
(4) D的最高价氧化物的水化物中含有____________键。
(5) 用电子式表示D2C的形成过程:________________________________。
下图中A~J均为中学化学中常见的物质,它们之间有如下转化关系。其中A、D为常见金属单质,B、C为金属氧化物,H为白色沉淀,I为红褐色沉淀。(反应过程中生成的水及其他产物已略去)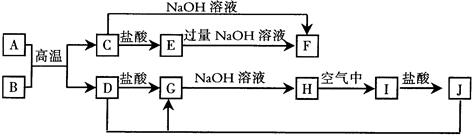
请回答以下问题:
(1)A在元素周期表中的位置是;写出A单质与NaOH溶液反应的化学方程式
(2)写出反应“J+D→G”的离子方程式:;实验室也可以将G直接转化为J,所用的试剂为。
(3)C与NaOH溶液反应、E与过量的NaOH溶液反应,其产物之一都含A元素,该产物中A元素的存在形式为(用化学符号表示)。